Knallquecksilber
Knallquecksilber (chemisch: Quecksilber(II)-fulminat) ist das Quecksilbersalz der Knallsäure. Es bildet in reinster Form farblose Kristalle. Knallquecksilber ist giftig und zerfällt schon bei geringer mechanischer oder thermischer Belastung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
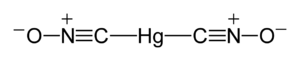 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Knallquecksilber | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Hg(CNO)2[1] | |||||||||||||||
| Kurzbeschreibung |
weiß-graues Pulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 284,62 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,42 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (100 mg·l−1 bei 15,5 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,1 mg·m−3[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Das Knallquecksilber wurde wahrscheinlich bereits Ende des 17. Jahrhunderts von Kunkel von Löwenstern und anderen Alchemisten erstmals isoliert. Die Herstellung aus Quecksilber, Ethanol und Salpetersäure wird erstmals 1799 von dem Engländer E. Howard beschrieben.
Aufgrund seiner ausgeprägten Initiierfähigkeit war Knallquecksilber seinerzeit der am weitesten verbreitete Initialsprengstoff. Es wurde in Zündhütchen und Sprengkapseln verwendet. Alfred Nobel setzte Knallquecksilber in Sprengkapseln zur Zündung von Dynamit ein. Erst diese relativ sichere Zündmethode begründete den breiten Erfolgskurs von Dynamit-Sprengstoffen. Allein im Deutschen Reich betrug die Jahresproduktion an Knallquecksilber Anfang des 20. Jahrhunderts etwa 100 t.
Inzwischen ist Knallquecksilber allerdings durch andere Stoffe ersetzt worden, z. B. Bleiazid.
Gewinnung und Darstellung
Quecksilberfulminat wird durch Umsetzung von elementarem Quecksilber oder Quecksilber(II)-oxid mit konzentrierter Salpetersäure in Gegenwart von Ethanol hergestellt. Die Synthese größerer Mengen an Quecksilberfulminat erfordert strenge Sicherheitsvorkehrungen und darf nur durch ausgebildetes Fachpersonal erfolgen.
Zur Darstellung kleiner Mengen kann das 1901 von dem Italiener Angelico beschriebene Verfahren für Silberfulminat benutzt werden. Anstelle von Ethanol erfolgt die Umsetzung hier mit wässrigen Lösungen von Malonsäure und Natriumnitrit.
Verunreinigungen durch Nebenprodukte können durch ein- oder mehrmaliges Umkristallisieren aus Ammoniak-Lösung beseitigt werden. Aus wässrigen Lösungen kristallisiert Knallquecksilber als Hemihydrat Hg(CNO)2 · ½ H2O aus.[4]
Eigenschaften

Physikalische Eigenschaften
Quecksilberfulminat ist in heißem Wasser, Ethanol und in Salpetersäure gut, in kaltem Wasser hingegen nur schlecht löslich.
Chemische Eigenschaften
Bereits bei geringer mechanischer oder thermischer Belastung zerfällt Quecksilberfulminat explosionsartig. Dabei entstehen elementares Quecksilber, Stickstoff und Kohlenstoffmonoxid:
Hierbei kann der Zerfall durch Verdämmen oder Zünden größerer Mengen leicht in eine Detonation (v = 5000 m/s) übergehen.
Da bei der Explosion eine Wolke von atomarem, giftigem Quecksilberdampf entsteht, wird es als Sprengstoff heute nicht mehr verwendet.
Kristallstruktur

Untersuchungen zum Kristallgitter des Knallquecksilber wurden bereits in den 1930er Jahren durchgeführt. Erst 2007 wurden klare Ergebnisse erzielt.[5] Knallquecksilber liegt demnach orthorhombisch vor. Die Hg-Atome und die zwei umgebenen C-Atome sind – wie bereits vermutet – linear angeordnet, so dass die molekulare, gestreckte Anordnung von O-N-C-Hg-C-N-O bestätigt wird.
Sicherheitshinweise
Quecksilberfulminat ist ein Initialsprengstoff und daher besonders explosionsgefährlich. Es kann durch Zündquellen oder mechanische Einwirkung wie Reibung oder Stoß zur Explosion kommen, aber auch durch die Einwirkung von Strahlung, durch Trocknen oder Kontakt mit anderen chemischen Verbindungen, wie beispielsweise Schwefelsäure.
Quecksilberfulminat ist giftig und umweltgefährlich; für Wasserorganismen stellt es ein besonders hohes Gefahrenpotential dar. Unter Wasser gelagert ist es nicht explosionsfähig und chemisch stabil.
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-76.
- Eintrag zu Quecksilberfulminat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Februar 2017. (JavaScript erforderlich)
- Eintrag zu Mercury difulminate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Wissenschaft-Online-Lexika: Eintrag zu „Quecksilberfulminat“ im Lexikon der Chemie, abgerufen am 11. Juli 2013.
- Beck, Evers, Göbel, Oehlinger, Klapötke: The Crystal and Molecular Structure of Mercury Fulminate (Knallquecksilber). Z. anorg. allg. Chem. 2007, Bd. 633, Nr. 9, S. 1417–1422.
Literatur
- R. Knoll: Das Knallquecksilber und andere Sprengstoffe., Survival Press, Radolfz., November 2001, ISBN 3-8311-2876-6
- A. Stettbacher: Die Schieß- und Sprengstoffe. 2. Auflage, Leipzig, 1933.



