Szintillationszähler
Als Szintillationszähler – seltener, aber genauer auch als Szintillationsdetektor – bezeichnet man ein auf der Szintillation basierendes Messgerät zur Bestimmung der Energie und der Intensität von ionisierender Strahlung.

Geschichte
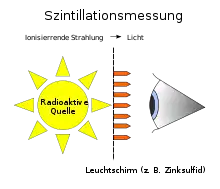
Die Szintillationsmessung ist eine der ältesten Messmethoden zum Nachweis von ionisierender oder Röntgen-Strahlung. Ursprünglich wurde ein Zinksulfidschirm in den Strahlengang gehalten und die Szintillationsereignisse entweder als Blitze gezählt oder im Fall der Röntgendiagnostik als Bild betrachtet (Abb. 1). Ein als Spinthariskop bezeichneter Szintillationszähler wurde von Rutherford zur Untersuchung der Streuung von α-Teilchen an Atomkernen eingesetzt.
Aufbau und Funktion
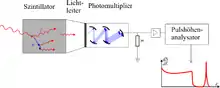
Im Kopf des Messgerätes befindet sich ein gegen äußeren Lichteinfall (und Feuchtigkeit, z. B. bei Verwendung des sehr hygroskopischen Natriumiodids) geschützter Szintillator, in dem durch die ionisierende Strahlung (indirekt) mehrere Lichtblitze ausgelöst werden, deren Anzahl von der Energie der einfallenden Strahlung abhängt. Diese sehr schwachen Lichtblitze setzen aus der Photokathode des dahinter angebrachten Photomultipliers Elektronen frei (Photoeffekt). Diese Elektronen werden durch Stöße an den Elektroden im Photomultiplier lawinenartig vervielfacht. An der Anode kann dann ein gut messbarer Stromimpuls abgenommen werden, dessen Amplitude von der Energie der einfallenden Strahlung abhängig ist. Bei besonders kompakten Szintillationszählern wird anstelle des Photomultipliers auch eine empfindliche Photodiode eingesetzt.
Je nach Szintillator eignet sich ein Szintillationszähler zur Messung von Alpha-, Beta-, Gamma- oder Neutronenstrahlung.
Für das transparente Szintillationsmaterial kommen sowohl anorganische Salze als auch organische Kunststoffe oder Flüssigkeiten in Frage (siehe Szintillator). Anorganische Substanzen haben den Vorteil, dass man mit ihnen eine höhere Dichte erzielen kann, was für Gammastrahlung die Absorptionsfähigkeit und damit die Empfindlichkeit des Zählers verbessert. Ein häufig eingesetzter Stoff ist Natriumiodid (NaI), welches für diesen Zweck mit geringen Mengen Thallium (Tl, ca. 0,1 %) dotiert wird. Andere Materialien sind zum Beispiel Lanthanchlorid (LaCl3) oder Cäsiumiodid (CsI),[1] sowie das auch für höherenergetische Gammastrahlung empfindliche Bismutgermanat (BGO) (Bi4Ge3O12) und das mit Ce3+ dotierte Lutetiumyttriumoxyorthosilicat, LuYO[SiO4] oder Lutetiumoxyorthosilicat, Lu2O[SiO4].
Mit einem Szintillationszähler lassen sich β- und γ-Spektren aufnehmen (siehe Gammaspektroskopie), was beispielsweise mit einem Geiger-Müller-Zählrohr nicht möglich ist.
Die Energieauflösung von Szintillationszählern ist i. A. besser als bei Proportionalzählrohren, aber wiederum nicht so gut wie die von Halbleiterdetektoren, z. B. Siliziumdetektoren für Teilchenstrahlung oder gekühlten Germaniumdetektoren für Gammastrahlung.
Einsatz
Szintillationszähler finden in verschiedenen Bereichen seit langem praktischen Einsatz. So werden zum Beispiel in der Nuklearmedizin beim Verfahren der Positronen-Emissions-Tomographie Szintillationszähler als Detektoren für die Annihilations-Photonen ringförmig angeordnet, um dreidimensionale Schnittbilder von Organen zu erzeugen.
Ein weiteres Hauptanwendungsgebiet von Szintillatoren ist der Nachweis von Gammaquanten in Kalorimetern der Teilchenphysik. Sie werden auch häufig zur Triggerung anderer Detektoren, die detailliertere Informationen liefern, und in Hodoskopen eingesetzt.
Durch die Kombination zweier verschiedenartiger Szintillatoren in einem Detektor können mit Hilfe der sogenannten ΔE-E-Messung nicht nur Rückschlüsse auf die Energie E der detektierten Teilchen, sondern auch auf deren Masse gemacht werden. Dabei werden ein dünner, schneller Szintillator, der die zu detektierenden Teilchen nur etwas abbremst (Energieverlust ) und ein dickerer, langsamer Szintillator verwendet, der die Teilchen danach vollständig auffängt. Das Licht der beiden Szintillatoren kann dann mit einem einzigen Lichtdetektor aufgefangen werden. Die Signale können wegen der unterschiedlichen Reaktionszeiten der Szintillatoren elektronisch getrennt und ins Verhältnis gesetzt werden.
Ebenfalls wichtig ist der Einsatz als primärer Detektor in Rasterelektronenmikroskopen (sogenannter Everhart-Thornley-Detektor).
Flüssigszintillationszähler
Ein wichtiges Einsatzgebiet für Szintillationszähler ist die Messung der Konzentration radioaktiv markierter Stoffe z. B. in der Biochemie. Dabei müssen meist kleine Mengen (spezifische Aktivitäten) von Radionukliden wie Tritium (3H), Kohlenstoff-14 (14C) oder Schwefel-35 (35S) bestimmt werden, und gerade diese Nuklide geben überdies nur Betastrahlung (β-Strahlung) geringer Energie ab, die in Materie stark absorbiert wird. Hier eignet sich am besten ein flüssiger Szintillator, in dem die zu messende Stoffprobe gelöst wird, so dass nahezu alle emittierten Beta-Elektronen vom Szintillator erfasst werden. Die Lichtblitze werden wie bei anderen Szintillationszählern durch einen Photomultiplier in elektrische Impulse umgewandelt und einer Zählanordnung zugeführt.
(Von dieser Technik zu unterscheiden sind Flüssigszintillatoren, die in abgeschlossenen Glas- oder Metall-Glas-Gefäßen wie feste Szintillatoren verwendet werden und zur Messung schneller Neutronen dienen.)
Die zu messende β-strahlende Probe soll in der Lösung möglichst homogen verteilt sein, um die beste Zählausbeute (Wirkungsgrad) zu erreichen. Die Flüssigkeit besteht darum aus folgenden Komponenten:
Lösungsmittel
Das Lösungsmittel hat zunächst die Aufgabe, den eigentlichen Szintillator und die zu messende Probe zu lösen. Weiterhin muss es die Energie der Strahlung als Anregungsenergie aufnehmen und an den gelösten Szintillator übertragen. Für diese doppelte Aufgabe eignen sich besonders aromatische Lösungsmittel. Gebräuchlich sind Toluol, Xylol und Cumol oder Pseudocumol.[2]
Szintillatoren
Der eigentliche Szintillator hat die Aufgabe, die Anregungsenergie vom Lösungsmittel zu übernehmen und in Lichtquanten umzuwandeln. Er muss also im Lösungsmittel gut löslich sein und ein für die Photokathoden der Photomultiplier geeignetes Fluoreszenzspektrum emittieren. Die chemischen Bezeichnungen der Szintillatoren sind für die Praxis etwas unhandlich. Es hat sich darum eingebürgert, nur Abkürzungen zu verwenden.[3]
Hier einige Beispiele für Szintillatoren:
- PBD = 2-Phenyl-5-(4-biphenyl)-1,3,4-oxadiazol
- PPO = 2,5-Diphenyloxazol
- BBOT = 2,5-Bis-[5'-tert.butyl-benzoxazolyl(2')]-thiophen
- POPOP = p-Bis-5-phenyl-oxazolyl(2)-benzol
Zusätze
Wenn die zu messende Substanz (das Probensystem) in den bisher genannten Komponenten Lösungsmittel und Szintillator nicht löslich ist, werden Zusätze verwendet, die meist die Aufgabe von Lösungsvermittlern haben. Beispielsweise wird durch Zusatz von Alkohol zum Toluol eine bedingte Aufnahmefähigkeit für wässrige Proben erreicht. Dabei sinkt jedoch die Wirksamkeit des Szintillators.
Szintillationsvorgang
Wird im flüssigen Szintillator ein β-Teilchen emittiert, so werden längs der Bahn des Teilchens die Lösungsmittelmoleküle angeregt. Die angeregten Lösungsmittelmoleküle übertragen ihre Energie auf den Szintillator, der die übernommene Anregungsenergie als Fluoreszenzlicht abstrahlt. Die Zahl der angeregten Moleküle hängt dabei von der Weglänge des emittierten Elektrons im Szintillator ab. Die Anzahl der pro Zerfall emittierten Photonen ist damit abhängig von der Energie des primären Strahlungsteilchens.
Aufbau des Messgerätes
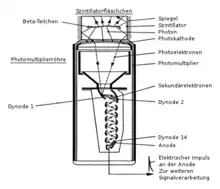
Im Messgerät werden die im Szintillator pro Zerfallsakt entstehenden Lichtblitze in einem Photomultiplier (siehe Abb. 3) in elektrische Impulse umgewandelt. Da die Verstärkung in dem Photomultiplier proportional ist, das heißt, alle Impulse werden um den gleichen Faktor größer, ist die Höhe des elektrischen Impulses am Ausgang proportional zur Energie des beobachteten Teilchens.
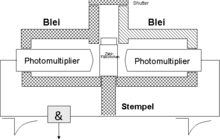
Bei normaler Umgebungstemperatur entstehen im Photomultiplier elektrische Impulse (Rauschen, Dunkelstrom), die bei der Probenmessung mitgezählt werden, aber nicht durch die Probe ausgelöst wurden. Um diese zu unterdrücken, benutzt man zwei Photomultiplier und eine elektrische Schaltung, die nur solche Impulse zur Zählung zulässt, die von beiden Photomultipliern gleichzeitig abgegeben wurden (Koinzidenzmessung) (siehe Abb. 4).
Das gemessene Spektrum enthält nicht in allen Bereichen Informationen von der Probe, sondern teilweise auch aus anderen Quellen, z. B. der Höhenstrahlung. Zur Reduzierung dieses Messuntergrundes benutzt man Diskriminatoren. Eine Diskriminator-Einheit erlaubt die Auswahl bestimmter Bereiche des Spektrums; andere Bereiche werden von der Zählung ausgeschlossen (diskriminiert). Für die Messung eines β-Strahlers wird das Gerät so eingestellt, dass das Impulsratenmaximum im Fensterbereich zwischen der unteren und oberen Diskriminatorschwelle liegt. Durch den Einsatz mehrerer Diskriminatoreinheiten kann in mehreren Energiebereichen gleichzeitig gemessen werden.
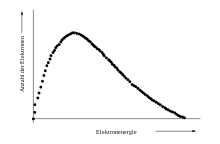
Moderne Geräte verfügen über Vielkanalanalysatoren. Dadurch ist es möglich, jedes gemessene β-Teilchen einem kleinen Energiefenster zuzuordnen. Werden in einem Koordinatensystem alle Energiefenster (Kanäle) nebeneinander dargestellt, erhält man ein Energiespektrum (siehe Abb. 5).
Fehlermöglichkeit durch den „Quench“ und die Wirkungsgradkontrolle
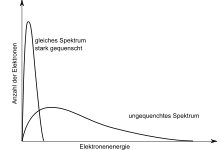
Wenn bei gleicher Strahlungsenergie der Teilchen durch chemische Substanzen oder eine Einfärbung der Probe nicht alles Fluoreszenzlicht an den Photomultipliern ankommt, wird das Spektrum zu niedrigeren Energien verschoben. Ein Teil der Impulse wird zu klein, um gezählt zu werden. Die Ausbeute sinkt. Dieser Effekt wird Quench genannt.
Grundsätzlich unterscheidet man zwei Arten von Quench:
Chemischer Quench
Beim Energietransport vom angeregten Lösungsmittelmolekül zum Photonen erzeugenden Szintillator wird ein Teil der Energie auf nicht fluoreszenzfähige Moleküle übertragen. Statt der gewünschten Photonen entsteht Wärme.
Optischer Quench
Bereits vom Szintillator emittierte Photonen werden in der Lösung selbst absorbiert. Diesen Vorgang bezeichnet man als „optischen Quench“.
Beide Quencharten führen zum gleichen Effekt, das Impulsspektrum wird zu niederen Energien hin verschoben (siehe Abb. 6). Dadurch wandert das Impulsspektrum aus dem einmal optimal eingestellten Fenster heraus, der Wirkungsgrad ändert sich. Daher ist es bei der Messung mit flüssigen Szintillatoren immer notwendig, den Wirkungsgrad der Messung zu kontrollieren und beim Vergleich von Proben, die mit unterschiedlichem Wirkungsgrad gemessen wurden, Korrekturen durchzuführen. Für die Kontrolle des Wirkungsgrades gibt es im Wesentlichen zwei Methoden:
Wirkungsgradbestimmung mit „internem Standard“
Bei der Wirkungsgradbestimmung mit „internem Standard“ wird die zu messende Probe mit Szintillator in ein Probengefäß gegeben und gemessen. Anschließend wird eine genau bekannte Aktivität (der interne Standard) zur Probe hinzugefügt und erneut gemessen. Die Differenz der Zählraten zwischen der zweiten und der ersten Messung ergibt die Zählrate des internen Standards. Diese Zählrate wird durch die eingesetzte bekannte Aktivität dividiert, man erhält so den Wirkungsgrad für die Messung des internen Standards. Dieser Wirkungsgrad wird dann auf die Messung der Probe übertragen. Vorausgesetzt wird bei dieser Methode, dass durch die Zugabe des internen Standards kein weiterer Quench erfolgt, der Wirkungsgrad sich also nicht verändert.
Wirkungsgradbestimmung nach einer „Kennzahlmethode“
Die Kennzahlmethode benutzt den Effekt, dass durch den Quench eine Verschiebung des Impulsspektrums zu niederen Energien hin erfolgt. Aus dieser Verschiebung wird eine Kennzahl gewonnen, der über eine Eichmessung der Wirkungsgrad zugeordnet wird. Die graphische Darstellung des Wirkungsgrades als Funktion der zugehörigen Kennzahl bezeichnet man als Quench-Kurve. Nur bei Proben mit gleicher Kennzahl können die Messwerte unmittelbar verglichen werden. Beim Vergleich von Proben mit unterschiedlicher Kennzahl muss zunächst eine Quenchkorrektur durchgeführt werden. Aus der Kennzahl wird mit Hilfe der aufgenommenen Quenchkurve der zugehörige Wirkungsgrad ermittelt und die gefundene Zählrate auf die absolute Aktivität umgerechnet. Die älteste Kennzahlmethode ist die Kanalverhältnismethode. Bei der Kanalverhältnismethode wird zusätzlich zum optimal eingestellten Messkanal ein zweiter Kanal als Vergleichskanal benutzt, dessen Fensterbreite durch Erhöhung der unteren Schwelle oder Erniedrigung der oberen Schwelle gegenüber dem Messkanal verringert ist. Auf diese Weise erhält man bei jeder Messung einer Probe zwei Zählraten, wobei die Zählrate im verkürzten Vergleichskanal stets kleiner ist. Dividiert man die Zählrate des Vergleichskanals durch die Zählrate des Messkanals, so erhält man einen Quotienten, der von der Größe der Zählraten unabhängig ist und nur noch von der Lage des Spektrums in den zwei Kanälen abhängt. Wird durch unterschiedlichen Quench die Lage des Impulsspektrums in den Messfenstern verschoben, so wirkt sich diese Verschiebung im Messkanal und Vergleichskanal unterschiedlich aus, der Quotient der Zählraten ändert sich. Auf diese Weise hat man zunächst einmal eine Kenngröße für den Wirkungsgrad. Bei Proben mit gleichem Quotienten liegt das Impulsspektrum im gleichen Fensterbereich, sie werden mit gleichem Wirkungsgrad gemessen. Proben mit unterschiedlichem Quotienten werden mit unterschiedlichem Wirkungsgrad gemessen. Über eine Eichreihe mit genau bekannten Aktivitäten aber unterschiedlichem Quench erhält man zu jedem Wirkungsgrad im Messkanal auf diese Weise einen Quotienten als Kennzahl.
Für die Gewinnung der Kanalverhältnisquotienten als Kennzahl sind zwei Verfahren gebräuchlich. Nach dem ersten Verfahren benutzt man zur Gewinnung der zwei Zählraten in den unterschiedlichen Kanälen die Impulsraten der Probe. Die aus dem Probenspektrum gewonnene Kennzahl heißt darum Probenkanalverhältnis. Da wegen der häufig geringen Zählraten der Proben zur statistischen Sicherung der Ergebnisse vor allem für den verkürzten Kanal oft lange Messzeiten erforderlich sind, wird meist für die Quotientenbildung ein Gammastrahler von außen an das Probenfläschchen gebracht und über die Compton-Elektronen in der Szintillatorlösung ein der β-Probe vergleichbares Spektrum erzeugt. Dieses Impulsspektrum unterliegt einer ähnlichen Quenchwirkung wie das Probenspektrum. Da auf diese Weise hohe Zählraten erzeugt werden können, genügen für die Bestimmung des Quotienten kurze Messzeiten. Wird der Quotient über das Compton-Spektrum einer externen Gammaquelle gewonnen, bezeichnet man dies Verfahren als Externer-Standard-Kanalverhältnis. Die eigentliche Messung der Probe ist so zeitlich von der Bestimmung des Quotienten getrennt und erfolgt entweder vor oder nach der Kennzahlbestimmung.
Direkt messbare Proben in homogener Phase
Früher mussten für viele Anwendungen Szintillatoren in Eigenregie hergestellt werden. Heute gibt es ein breit gefächertes Angebot, das fast alle Einsatzmöglichkeiten berücksichtigt. Es ist wichtig, seine Proben gut charakterisieren zu können, um dann nach Absprache mit einer Herstellerfirma den richtigen Cocktail zu bekommen. Viele Proben brauchen daher für die Messung nicht mehr aufgearbeitet zu werden, es sei denn, sie sind beispielsweise sehr trüb oder enthalten stark quenchende Substanzen. In der Umweltmesstechnik haben Szintillatoren große Bedeutung erlangt, die sehr viel Wasser aufnehmen können (über 50 %). Wenn die Messprobe in den Szintillator gegeben wird, ist es wichtig, die Probe gut zu schütteln. Danach muss kontrolliert werden, ob eine homogene Phase vorliegt. Bei Ausnutzung der Aufnahmekapazität des Cocktails ist zu kontrollieren, ob eine Phasentrennung stattfindet. Proben, die nach dem Schütteln trüb sind, klären sich oft nach einiger Zeit. Das Kühlen der Proben hat sich bewährt, um Lumineszenzerscheinungen zu minimieren.
Direkt messbare Proben in heterogener Phase
Fein verteilte feste Stoffe oder größere Volumina von Flüssigkeiten können im heterogenen Messsystem gemessen werden. Dabei ist es wichtig, die Proben sehr fein im Szintillatorsystem zu verteilen, um einen guten Kontakt zum Szintillator herzustellen. Durch Selbstabsorption der Strahlung in den Probenteilchen wird jedoch eine genaue Wirkungsgradbestimmung schwierig. Die Dispersion der Probe im Szintillator muss durch geeignete Emulgatoren oder Gelbildner stabilisiert werden. Als Gelbildner wird unter anderem fein verteiltes Kieselgel (Cab-O-Sil) benutzt. Je nach Probenphase unterscheidet man Messungen in Emulsionen oder Suspensionen. Zur Gruppe der Messungen in heterogener Phase gehört auch das Einbringen von Filterstreifen oder ähnlichem Material mit darauf fest haftender und im Szintillator nicht löslicher radioaktiver Substanz.
Absorption gasförmiger Proben
Häufig ist es notwendig 14C-, 35S- oder 3H-haltige Gase zu messen. Bei 3H kann davon ausgegangen werden, dass die zu bestimmende Aktivität als Wasser gebunden ist. In diesem Fall friert man das Wasser mit einer Kühlfalle aus der Luft aus. Liegen die Kontaminationen als Staubteilchen vor, können diese auf Filtern abgeschieden werden. Diese Filter werden direkt in den Szintillator gegeben. Saure Gase werden in einer organischen Base wie Benzethoniumhydroxid (Hyamin 10-X, Ethanolamin oder Phenylethylamin) absorbiert und im Szintillatorsystem gelöst.
Solubilisierung
Bei der Solubilisierung wird die hochmolekulare Struktur des biologischen Probenmaterials so weit abgebaut, dass eine homogene Lösung mit Hilfe von Lösungsvermittlern ermöglicht wird. Als Abbaureagenzien und Lösungsvermittler haben sich dabei besonders quaternäre Ammoniumbasen bewährt. Daneben ist auch enzymatische Hydrolyse oder Aufschluss mit Ameisensäure gebräuchlich. Bei Proben, die in ein Polyacrylamid-Gel eingebettet sind, kann man für das Gel an Stelle von N,N′-Methylenbisacrylamid N,N′-Diallyltartardiamid verwenden, und das Gel nach dem Trennlauf mit Natriumperiodatlösung durch Glycolspaltung auflösen.
Probenverbrennung
Die radikalste Form der Probenwandlung biologischer Proben ist die Probenverbrennung. Dabei wird entweder in Lösung (Nassoxidation) oder durch Verbrennung in Sauerstoffatmosphäre (trockene Oxidation) die Substanz zu CO2 und Wasser verbrannt. Das entstandene CO2 wird absorbiert und zur Messung gebracht. Bei der trockenen Oxidation ist es möglich, CO2 und entstandenes Wasser zu trennen und auf diese Weise 3H und 14C aus einer Probe getrennt zu messen.
Literatur
- Alfred Pingoud, Claus Urbanke: Arbeitsmethoden der Biochemie. de Gruyter, Berlin u. a. 1997, ISBN 3-11-014696-7.
- Günter Schatz, Alois Weidinger, Manfred Deicher: Nukleare Festkörperphysik: Kernphysikalische Messmethoden und ihre Anwendungen. Vieweg + Teubner, Wiesbaden 2010, ISBN 978-3-8351-0228-6.
- William R. Leo: Techniques for Nuclear and Particle Physics Experiments: A How-to Approach. Springer, New York 1994, ISBN 978-0-3875-7280-2.
Weblinks
Einzelnachweise
- Kevin Klipsch: Neutronenaktivierungsanalytische Untersuchungen zur Bestimmung von radioökologischen Parametern aus dem Langfristigen Eintrag von 129I, Diplomarbeit Uni Hannover (2002).
- Cocktails für die Messungen im Szintillationszähler (PDF; 271 kB).
- Eine schnelle Methode zur Messung von α-Strahlern mit extrahierendem Szintillator und Pulse Decay Analyse (PDF; 170 kB).