Iodsäure
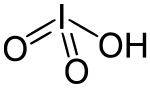
Iodsäure, auch Jodsäure, ist eine Halogensauerstoffsäure, wie Chlorsäure und Bromsäure. Sie ist die einzige der Halogen(V)-säuren des Typs HXO3, die sich wasserfrei isolieren lässt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Iodsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | HIO3 | |||||||||||||||
| Kurzbeschreibung |
farblose, rhombische, piezoelektrische Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 175,91 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,63 g·cm−3 [2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
0,804[4] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Iodsäure wird durch Oxidation von Iod mit starken Oxidationsmitteln wie Salpetersäure (HNO3), Chlor, Chlorsäure oder Wasserstoffperoxid (H2O2) gewonnen:[5]
Die entstehende Salzsäure muss aus dem Gleichgewicht entfernt werden, da sie die Iodsäure wegen der Rückreaktion reduzieren und das Gleichgewicht auf die linke Seite verschieben würde. Dies kann beispielsweise mit Quecksilber(II)-oxid (HgO) erreicht werden.
Eigenschaften
Nach dem VSEPR-Modell ist Iodsäure trigonal pyramidal aufgebaut. Iodsäure bildet durchsichtige, farblose, rhombische Kristalle, die sich in Wasser sehr leicht lösen. Der Stoff ist eine mittelstarke Säure mit dem pKs-Wert 0,804 und wirkt stark oxidierend. Iodsäure ist polymorph. Neben der thermodynamisch stabilen, nichtzentrosymmetrischen α-Form existiert auch eine metastabile, zentrosymmetrische γ-Form.[6]
Iodate
Iodate sind die Salze der Iodsäure der allgemeinen Formel M(IO3)n (M=Metall, n=abhängig von der Wertigkeit des Metalls). Sie sind beständiger als Chlorate und Bromate, aber wie diese starke Oxidationsmittel. Aus Iodaten kann man Iodsäure durch Reaktion mit Schwefelsäure freisetzen.
Sicherheitshinweise
Iodsäure und Iodate sind sehr starke Oxidationsmittel und können mit reduzierenden Stoffen wie Schwefel, Metallpulver oder organischen Substanzen explosionsartig reagieren.
Einzelnachweise
- Eintrag zu Iodsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- Datenblatt Iodic acid bei Sigma-Aldrich, abgerufen am 13. Mai 2017 (PDF).
- Eintrag zu Iodsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., Band 1, Academic Press 1963, S. 316–8.
- A. Fischer, M. Lindsjö: γ-HIO3 – a metastable, centrosymmetric polymorph of iodic acid. In: Zeitschrift für anorganische und allgemeine Chemie. 631(9), 2005, S. 1574–1576, doi:10.1002/zaac.200500099.

