Iodtrifluorid
Iodtrifluorid ist eine chemische Verbindung von Iod und Fluor. Die Interhalogenverbindung ist wie andere dieser Stoffklasse sehr instabil und zersetzt sich leicht.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
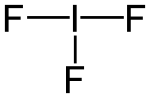 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Iodtrifluorid | ||||||||||||
| Andere Namen |
Iod(III)-fluorid | ||||||||||||
| Summenformel | IF3 | ||||||||||||
| Kurzbeschreibung |
gelber Feststoff (−78 °C)[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 183,9 g·mol−1 | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Iodtrifluorid wurde erstmals 1960 vom deutschen Chemiker Martin Schmeißer aus den Elementen Iod und Fluor dargestellt.[4][5]
Gewinnung und Darstellung
Iodtrifluorid ist auf mehreren Wegen darstellbar. Neben der Synthese aus den Elementen ist es möglich, die Verbindung durch Reaktion von Iod mit Xenon(II)-fluorid in Trichlorfluormethan zu gewinnen.[6]
Eigenschaften
Die Struktur des IF3-Moleküls lässt sich über das VSEPR-Modell erklären. Neben den drei Fluor-Liganden besitzt das Iod-Atom noch zwei freie Elektronenpaare. Mit diesen bildet das Molekül eine trigonale Bipyramide, betrachtet man nur die Atome, erscheint es T-förmig. Die axialen Fluor-Iod-Bindungen besitzen eine Länge von 198 pm, die äquatoriale eine Länge von 187 pm. Die Winkel zwischen den Fluoratomen betragen 80,1 °.[2]
Iodtrifluorid ist nur bei Temperaturen von unter −28 °C stabil. Wird es über diese Temperatur erwärmt, zersetzt es sich zu Iod und Iodpentafluorid. Wie andere Interhalogenverbindungen ist Iodtrifluorid ein Fluorierungsmittel, jedoch schwächer als Brom- oder Chlortrifluorid.[2]
Verwendung
Iodfluorid lässt sich durch Reaktion von Iodtrifluorid mit Iod in Trichlorfluormethan bei tiefen Temperaturen darstellen.[4]
Einzelnachweise
- Iodtrifluorid bei Webelements.com.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 459–460.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- M. Schmeisser, E. Scharf: Über Jodtrifluorid JF3 und Jodmonofluorid JF. In: Angewandte Chemie, 1960, 72, 9, S. 324, doi:10.1002/ange.19600720912.
- Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 65 pdf.
- Thomas M. Klapötke, Inis C. Tornieporth-Oetting: Nichtmetallchemie. Wiley-VCH, Weinheim 1994, ISBN 3-527-29257-8.