Bromwasserstoff
Bromwasserstoff ist ein farbloses Gas, welches an feuchter Luft Nebel bildet, weil sich die Verbindung aus Brom und Wasserstoff gut in Wasser unter Bildung von Bromwasserstoffsäure löst.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Bromwasserstoff | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | HBr | |||||||||||||||
| Kurzbeschreibung |
farbloses, an feuchter Luft rauchendes Gas mit stechendem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,91 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−66,4 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert |
−8,9[4] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 2 ml·m−3 bzw. 6,7 mg·m−3[7] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung und Gewinnung
Die industrielle Herstellung von Bromwasserstoff erfolgt durch die Umsetzung von Brom mit einem Überschuss an Wasserstoff bei 500 °C.[8] Die Prozesstemperatur kann in Gegenwart von Platinkatalysatoren auf 375 °C reduziert werden.[8] Eine weitere wichtige Bromwasserstoffquelle sind Bromierungen am Aromaten, wo die Verbindung als Nebenprodukt anfällt.[8] Dabei läuft eine electrophile Substitutionsreaktion am Aromaten ab. Ein Beispiel ist die Reaktion von Toluol mit Brom. Durch Erwärmen oder durch Lichteinfall reagiert das Brom mit dem Toluol u. a. zu Benzylbromid und Bromwasserstoff, wobei die Flüssigkeit, die vorher braun war, entfärbt wird.[9]
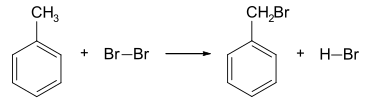
- Toluol und Brom reagieren zu Benzylbromid und Bromwasserstoff
Auch aus Natriumbromid kann Bromwasserstoff freigesetzt werden. Hierzu wird konzentrierte Phosphorsäure bei schwach erhöhter Temperatur auf den Feststoff getropft.
- Natriumbromid reagiert mit Phosphorsäure unter Entstehung von Bromwasserstoff und Dinatriumhydrogenphosphat
Alternativ kann auch Essigsäure anstatt Phosphorsäure verwendet werden:
Reaktion mit Wasser
Wird Bromwasserstoff in Wasser gelöst, dissoziiert das Bromwasserstoff-Molekül, es bilden sich Oxonium- und Bromidionen. Daher sinkt der pH-Wert, die Lösung reagiert als starke Säure.
Verwendung
Durch Radikaladdition von Bromwasserstoff zu Styrol kann 2-Bromethylbenzol gewonnen werden.[10]
Sicherheitshinweise
Durch Säurebildung in Wasser wirkt Bromwasserstoffgas reizend auf Augen und Atemwege und in hoher Konzentration auch giftig. (Gas-)Vergiftungen sind jedoch selten, weil es meist als wässrige Lösung (s. o.) verwendet wird und nach eventuellem Ausgasen rasch Nebel bildet. Bei vollständiger Verbrennung bromhaltiger organischer Stoffe kann neben Bromwasserstoff auch elementares Brom entstehen, das wesentlich giftiger ist.
Einzelnachweise
- Eintrag zu HYDROBROMIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Bromwasserstoff. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- Eintrag zu Bromwasserstoff, wasserfrei in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eberhard Gerdes: Qualitative Anorganische Analyse: Ein Begleiter für Theorie und Praxis. Springer DE, 2000, ISBN 3-540-67875-1, S. 154 (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-51.
- Eintrag zu Hydrogen bromide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 10035-10-6 bzw. Bromwasserstoff), abgerufen am 2. November 2015.
- Yoffe, D.; Frim, R.; Ukeles, S.D.; Dagani, M.J.; Barda, H.J.; Benya, T.J.; Sanders, D.C.: Bromine Compounds, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a04_405.pub2.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2. Auflage, Band 1, Academic Press 1963, S. 282–6.
- Ronny Neumann, Fernando de la Vega, Adva Bar-On: .alpha.-Bromo Carbonyl Compounds as Promoters for the Synthesis of (2-Bromoethyl)benzene by the Anti-Markovnikov Addition of Hydrogen Bromide to Styrene. In: The Journal of Organic Chemistry. Band 60, Nr. 5, März 1995, ISSN 0022-3263, S. 1315–1318, doi:10.1021/jo00110a040.


