Iodpentafluorid
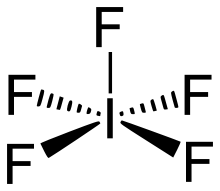
Iodpentafluorid ist eine Interhalogenverbindung, die aus den Elementen Iod und Fluor im Verhältnis 1:5 besteht.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Iodpentafluorid | |||||||||||||||
| Summenformel | IF5 | |||||||||||||||
| Kurzbeschreibung |
farblose, an der Luft rauchende, stechend riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 221,9 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
3,21 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt |
9,4 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Iodpentafluorid kann aus den Elementen hergestellt werden, indem man Iod in Fluor verbrennt.
Eigenschaften
Iodpentafluorid ist eine hochreaktive, stechend riechende, farblose und an der Luft rauchende Flüssigkeit, die die Atmungsorgane heftig angreift[1] und mit wasserstoffreichen organischen Verbindungen unter Flammenerscheinung und Bildung von Fluorwasserstoffsäure reagiert. Mit Lewis-Säuren und -Basen bildet sie die korrespondierenden Salze. Sie besitzt eine molare Verdampfungsenthalpie 41,37 kJ/mol und eine molare Schmelzenthalpie von 15,91 kJ/mol.
Die elektrische Leitfähigkeit beträgt 1,53·10−3S/m.
Iodpentafluorid ist hydrolyseempfindlich und reagiert mit Wasser heftig zu Iodsäure und Fluorwasserstoff:
Molekülgeometrie
Gasförmiges Iodpentafluorid besitzt gemäß dem VSEPR-Modell eine quadratisch-pyramidale Molekülgeometrie. Die vier FIF-Winkel betragen dabei 81,9°. Die axiale I–F-Bindung, welche die Spitze der quadratischen Pyramide bildet, besitzt eine Länge von 184,4 pm. Die vier planaren I–F-Bindungen, welche die quadratische Grundfläche der Pyramide bilden, haben eine Länge von 186,9 pm. Das freie Elektronenpaar am Iod-Atom ist dabei axial angeordnet, um einen möglichst großen Abstand zu den Fluor-Atomen zu gewährleisten.[4]
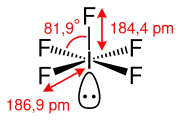
Iodpentafluorid besitzt als Molekülsymmetrie die Punktgruppe C4v.[4]
Verwendung
Iodpentafluorid wird als fluorierendes Reagens in der organischen Chemie und als Ätzmittel in der Halbleiterindustrie eingesetzt.
Weblinks
Einzelnachweise
- Eintrag zu Iodfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- Datenblatt bei solvay-fluorides.com (PDF).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 508–509 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche). (abgerufen über De Gruyter Online)