Kondensationsreaktion
Eine Kondensationsreaktion ist in der Chemie eine Reaktion, bei der sich zwei Moleküle unter Abspaltung von Wasser – alternativ auch Ammoniak, Kohlenstoffdioxid, Chlorwasserstoff, ein Alkanol oder ein anderer niedermolekularer Stoff – miteinander verbinden. Kondensationsreaktionen sind auch intramolekular möglich und verlaufen oft reversibel.
Ein Beispiel für die Kondensationsreaktion ist die enzymkatalysierte Reaktion zweier Aminosäuren zu einem Dipeptid nach folgendem Reaktionsschema:
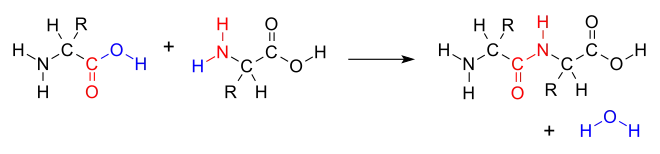
Die Kondensation spielt in der organischen Chemie eine wichtige Rolle. Dazu gehören unter anderem folgende Reaktionen:
- Hydrazonbildung
- Iminbildung
- Nukleotidbildung
- Peptid- und Proteinbildung
- Polykondensation zur Kunststoffherstellung
- Ugi-Reaktion
- Veresterung
- Säurekondensation
Die Kondensationsreaktion ist die Basis für die Herstellung vieler hochmolekularer Verbindungen, zum Beispiel Nylon, Polyester und verschiedener Epoxide, ebenso wie für Silicate und Polyphosphate. Auch die Synthese von Biopolymeren (Proteine, Polysaccharide, Fette, Nukleinsäuren) im Stoffwechsel der Zellen erfolgt durch Kondensationsreaktionen.
Die Reaktion, bei der Monomere zu einem Polymer reagieren, nennt man Polykondensationsreaktion. Im Gegensatz zu den anderen Arten der Polymergewinnung (Polymerisation und Polyaddition) werden bei der Polykondensation ein oder mehrere Nebenprodukte, die Kondensate (Wasser, Ammoniak, Alkohole oder andere), frei. Diese Nebenprodukte müssen kontinuierlich abgeführt werden, um einen hohen Umsatz zu erhalten (Massenwirkungsgesetz). Der Reaktionsumsatz einer Polykondensation muss deutlich oberhalb von 95 % liegen, da ansonsten nur kurzkettige Oligomere erhalten werden (Carothers-Gleichung). Damit ein Monomer an der Reaktion teilnehmen kann, muss es mindestens zwei funktionelle Gruppen besitzen, die reaktionsfähig sind (z. B. –OH, –COOH, –CO, –NH2, …).
Umkehrung
Die Umkehrung der Kondensationsreaktion ist die Hydrolyse (im Falle von Wasser; sonst auch Aminolyse, Alkoholyse, …); meist im sauren Milieu.
Olation und Oxolation
In der anorganischen Chemie ist die Olation eine zur Gruppe der Kondensationsreaktionen zählende Verbrückung von Elementatomen mit Hydroxid-Ionen (Kurzbezeichnung: Ol) unter einer Verdrängung von koordinativ gebundenem Wasser. Die Oxolation ist dagegen eine Verbrückung von Elementatomen mit Oxid-Ionen (Kurzbezeichnung: Oxo) unter einer Abspaltung von Wasser aus an dem entsprechenden am Element gebundenen Hydroxygruppen.[1] Olation und Oxolation sind verantwortlich für viele natürliche und synthetische Materialien, wie zum Beispiel Polymere und Polyoxometallate.

Literatur
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. Wiley-VCH, Weinheim 2000, ISBN 3-527-29819-3.
- R. Brückner: Reaktionsmechanismen: Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. 3., akt. und überarb. Auflage. Spektrum, 2004, ISBN 3-8274-1579-9.
Einzelnachweise
- Nils Wiberg, Arnold F. Holleman, Egon Wiberg, Gerd Fischer: Lehrbuch der anorganischen Chemie. 102., stark umgearb. u. verb. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1159.