Diiodpentoxid
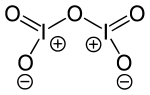
Diiodpentoxid, eine chemische Verbindung aus Iod und Sauerstoff mit der Formel I2O5, ist bei Raumtemperatur ein weißes, kristallines Pulver.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diiodpentoxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | I2O5 | |||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 333,81 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,98 g·cm−3 (20 °C)[2] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Iod(V)-oxid wird in zwei Reaktionsstufen hergestellt. Als erstes wird elementares Iod mit rauchender Salpetersäure bei 70–80 °C zur Reaktion gebracht. Hierbei entsteht Iodsäure HIO3:
Im zweiten Schritt wird die entstandene Iodsäure bei 240–250 °C entwässert[1]:
Diiodpentoxid bildet sich auch in einer Glimmentladung aus den Elementen. Die erste Darstellung von Diiodpentoxid erfolgte 1813 sowohl durch Davy als auch durch Gay-Lussac.
Eigenschaften
Diiodpentoxid bildet Molekülkristalle der Formel O2I–O–IO2, die bei 275 °C in die Elemente zerfallen.[3] Die Verbindung ist ein starkes Oxidationsmittel, diese Eigenschaft bestimmt im Wesentlichen ihre Verwendungen. Es ist sehr hygroskopisch[1] und in Wasser unter Rückbildung der Iodsäure löslich.
Struktur
I2O5 kristallisiert monoklin, Raumgruppe P21/c (Raumgruppen-Nr. 14), mit den Gitterparametern a = 11,04 Å, b = 5,063 Å, c = 8,135 Å und β = 107,2°. Der I–O–I Winkel in I2O5 beträgt 139,2°. Die terminalen I–O-Abstände betragen etwa 1,80 Å, die Abstände der verbrückenden I–O Bindungen liegen bei etwa 1,95 Å.[4]
Verwendung
Diiodpentoxid wird zur mengenmäßigen Bestimmung von Kohlenmonoxid in Gasgemischen verwendet, z. B. in der Elementar- und Rauchgasanalyse[5], da es bei Raumtemperatur quantitativ mit Kohlenmonoxid zu Kohlendioxid und elementarem Iod reagiert.
Das gebildete Iod kann durch Titration bestimmt werden. Auch in der organischen Chemie wird Diiodpentoxid zuweilen als Oxidationsmittel eingesetzt, so z. B. in der Herstellung von cyclischen Ketonen.[6]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 318–319.
- Datenblatt di-Iodpentoxid (PDF) bei Merck, abgerufen am 25. März 2011.
- Universität Freiburg: Chemie der Nichtmetalle, Kap. 4.4
- Kari Selte, Arne Kjekshus: Iodine oxides. Part III. The crystal structure of I2O5. In: Acta Chemica Scandinavica. Bd. 24, 1970, ISSN 0001-5393, S. 1912–1914, doi:10.3891/acta.chem.scand.24-1912.
- Universität Augsburg - Abgasmessung: Art und Weise sowie Hinweise zur Messung (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Kiyoshi Yoshida, Jiro Goto, Yoshio Ban: Oxidation of Cycloalkan [b] indoles with Iodine Pentoxide (I2O5). In: Chemical & Pharmaceutical Bulletin. Bd. 35, Nr. 12, 1987, ISSN 0009-2363, S. 4700–4704, doi:10.1248/cpb.35.4700.

