Hypoiodige Säure
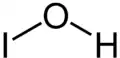
Als Hypoiodige Säure bezeichnet man die Sauerstoffsäure des Iods in der Oxidationsstufe +1. Sie hat die Summenformel HIO, ihre Salze werden Hypoiodite genannt. Hypoiodige Säure ist nur in wässriger Lösung kurzzeitig existent und kann nicht als Reinstoff isoliert werden.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hypoiodige Säure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | HIO | ||||||||||||
| Kurzbeschreibung |
nur in wässriger Lösung bekannt, nicht rein darstellbar[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 143,91 g·mol−1 | ||||||||||||
| pKS-Wert |
10,64 (25 °C)[1] | ||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Klassifizierung
Hypoiodige Säure gehört zur Stoffgruppe der Halogensauerstoffsäuren und dabei zur Untergruppe der Iodsauerstoffsäuren (Summenformeltypus HIOn mit n = 1, 2, 3, 4 sowie H5IO6) bzw. zur Untergruppe der Hypohalogenigen Säuren (Summenformeltypus HXO mit X = F, Cl, Br, I, At).[1]
Darstellung
Die Darstellung einer wässrigen Lösung der Hypoiodigen Säure kann analog der Hypochlorigen Säure HClO und der Hypobromigen Säure HBrO durch Ausnutzung der Disproportionierung elementaren Iods I2 (Iod in der Oxidationsstufe 0) in Wasser zu Iodwasserstoffsäure HI (Iod in der Oxidationsstufe −1) und Hypoiodiger Säure HIO (Iod in der Oxidationsstufe +1) erfolgen:
Um das weitgehend auf der linken Seite liegende Reaktionsgleichgewicht (Gleichgewichtskonstante 2,0·10−13 bei pH = 7 und 25 °C)[1] nach rechts zu verschieben, wird die Reaktion in Gegenwart einer Aufschlämmung von Quecksilber(II)-oxid HgO durchgeführt, wodurch die entstehende Iodwasserstoffsäure HI infolge Bildung von schwer löslichem basischem Quecksilber(II)-iodid (nachfolgend vereinfacht formuliert als HgI2·2 HgO) abgefangen wird:[1]
Um die Zersetzung der Hypoiodigen Säure zu verlangsamen, muss bei tiefen Temperaturen gearbeitet werden.
Eigenschaften
Säure-Base-Verhalten
Hypoiodige Säure HIO ist nur eine sehr schwache Säure, ihre Säurestärke (pKS-Wert von 10,64 bei 25 °C) ist ca. drei Größenordnungen kleiner als bei der Hypochlorigen Säure HClO und der Hypobromigen Säure HBrO.[1] Sie liegt daher vom sauren bis in den schwach alkalischen pH-Wert-Bereich hinein praktisch ausschließlich in Form undissoziierter HIO-Moleküle vor, erst bei zunehmend alkalischen pH-Werten befinden sich steigende Anteile ihrer korrespondierenden Base, des Hypoiodit-Anions IO−, im Gleichgewicht.
Instabilität, Redoxverhalten
Hypoiodige Säure HIO ist eine sehr unbeständige chemische Verbindung und zersetzt sich rasch in einer mehrstufigen Reaktion zu Iod I2 und Iodsäure HIO3 (als Zwischenprodukt tritt auch Iodige Säure HIO2 auf):[1]
1) Disproportionierung von Hypoiodiger Säure zu Iodwasserstoffsäure und Iodsäure
2) Komproportionierung von Iodwasserstoffsäure und Iodsäure zu Iod
3) Gesamtreaktion: Disproportionierung von Hypoiodiger Säure zu Iod und Iodsäure
Wie schon die Disproportionierungsneigung zeigt, kann Hypoiodige Säure HIO bzw. das Hypoiodit-Anion IO− sowohl als Oxidationsmittel als auch als Reduktionsmittel reagieren (Redoxamphoterie). Die Oxidationswirkung ist im Sauren ausgeprägter als im Alkalischen, was sich in einem höheren Redoxpotential äußert:[1]
| pH = 0 | pH = 14 | ||
|---|---|---|---|
| Redox-Paar | Normalpotential | Redox-Paar | Normalpotential |
| +0,99 V | +0,48 V | ||
| +1,44 V | +0,42 V | ||
| +1,13 V | +0,15 V | ||
Verwendung
Wahrscheinlich ist Hypoiodige Säure die aktive Spezies der in der Medizin zur Desinfektion verwendeten Iodlösung Iodwasser.
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 463–465, 468, 474, 2008 (eingeschränkte Vorschau der 101. Auflage in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Weblinks
- Universität Kiel: Iod (PDF-Datei; 165 kB)