Iodoform
Iodoform (Summenformel CHI3) ist eine gelbe, safranartig riechende chemische Verbindung aus Kohlenstoff, Wasserstoff und Iod und ein einfacher Halogenkohlenwasserstoff.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
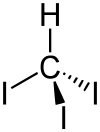 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Iodoform | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | CHI3 | |||||||||||||||||||||
| Kurzbeschreibung |
gelbe, glänzende Blättchen, hexagonale Tafeln oder zitronengelbes, feines Pulver mit safranartigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
D09AA13 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 393,73 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
4,008 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
218 °C[3] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
181,1 ± 1,0 kJ·mol−1[6] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||

Aufgrund seiner Struktur (CHX3) ist es homolog zu Fluoroform, Chloroform und Bromoform und analog benannt.
Nach Fieser & Fieser[7] ist Iodoform zusammen mit Tetraiodmethan die einzige farbige organische Verbindung ohne ungesättigtes Strukturelement.
Geschichte
Georges Serrulas stellte Iodoform 1822 erstmals her, Jean Baptiste Dumas stellte 1834 die Summenformel auf.
Gewinnung und Darstellung
Iodoform kann mithilfe Lugolscher Lösung aus Verbindungen mit CH3CHOH-Gruppe oder CH3CO-Gruppe wie Ethanol oder Aceton gewonnen werden. Diese Reaktion macht sich die Iodoformprobe zunutze, mit der die genannten Gruppen nachgewiesen werden können. Dazu löst man beispielsweise Ethanol in Natronlauge und gibt Lugolsche Lösung zu.
Der genaue Mechanismus für die Darstellung von Iodoform aus Ethanol oder Aceton verläuft ähnlich dem Mechanismus der Haloform-Reaktion.
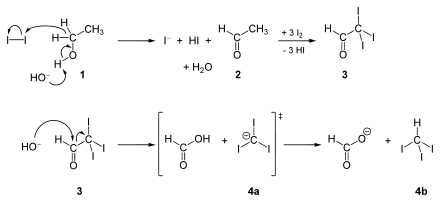
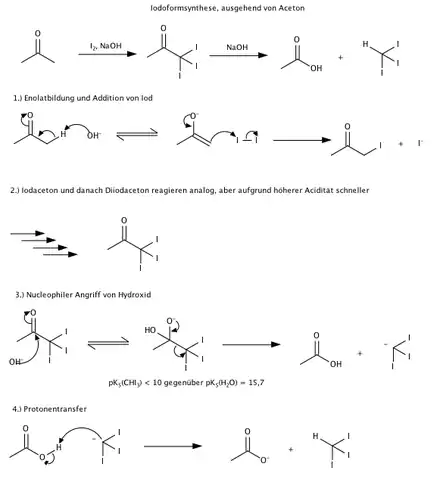
Iodoform lässt sich auch durch Elektrolyse aus einer warmen Lösung von Kaliumiodid, Natriumcarbonat und Ethanol in Wasser herstellen.
Verwendung
Es wird zur Takai-Olefinierung eingesetzt.[2]
Medizinische Verwendung
Früher wurde in Diethylether gelöstes Iodoform (Iodoformether) in der Dentalmedizin zur Desinfektion von Wunden verwendet, da es mit der Wundfeuchtigkeit eine kleine, desinfizierend wirkende Iodmenge abgibt. Zugleich trocknete es auch die Wunde, stillte kleinere Blutungen und verminderte die Wundschmerzen. Wegen seines charakteristisch intensiven Geruchs, des hohen Preises und der Schädlichkeit bei hohen Dosierungen wird Iodoform medizinisch kaum mehr verwendet. In der Zahnmedizin wird Iodoform nach wie vor sehr oft verwendet – es stellt das Standarddesinfektionsmittel zur Wundeinlage mittels Gazestreifen dar und wird als Füllpaste (mit Calciumhydroxid) in der Milchzahnwurzelfüllung benutzt.
Einzelnachweise
- Eintrag zu IODOFORM in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Juni 2020.
- Eintrag zu Iodoform. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2014.
- Eintrag zu Triiodmethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Februar 2020. (JavaScript erforderlich)
- Anhang I Stoffliste MAK-Werte und TRK-Werte, 2007.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-47-8 bzw. Iodoform), abgerufen am 2. November 2015.
- A. S. Carson, P. G. Laye, J. B. Pedley, Alison M. Welsby: The enthalpies of formation of iodomethane, diiodomethane, triiodomethane, and tetraiodomethane by rotating combustion calorimetry, in: The Journal of Chemical Thermodynamics, 1993, 25 (2), S. 261–269; doi:10.1006/jcht.1993.1025.
- Fieser, M. Fieser: Organische Chemie, 2. Auflage, Verlag Chemie, Weinheim 1979, S. 404–405.
Siehe auch
Weblinks
- Datenblatt Iodoform bei Sigma-Aldrich, abgerufen am 5. April 2011 (PDF).
