Natriumiodat
Natriumiodat ist eine chemische Verbindung (genauer das Natriumsalz der Iodsäure) aus der Gruppe der Iodate. Es ist ein licht-, luft- und feuchtigkeitsempfindlicher, farb- und geruchloser Feststoff.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
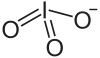 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumiodat | ||||||||||||||||||
| Andere Namen |
iodsaures Natrium | ||||||||||||||||||
| Summenformel | NaIO3 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,89 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,28 g·cm−3[1] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser (94,7 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Natürlich kommt Natriumiodat in einigen Mineralien und Verbindungen z. B. als Beimengung in Chilesalpeter vor.
Gewinnung und Darstellung
Natriumiodat kann durch Reaktion einer Natrium enthaltenden Base wie zum Beispiel Natriumhydroxid mit Iodsäure hergestellt werden:
Weiterhin ist die Darstellung durch Reaktion von Iod mit einer heißen Natriumhydroxidlösung möglich:
Eigenschaften
Natriumiodat ist ein Oxidationsmittel. Es kristallisiert im orthorhombischen Kristallsystem mit den Gitterparametern a = 5,75 Å, b = 6,37 Å und c = 4,05 Å.[4] Von der Verbindung sind ein Monohydrat und ein Pentahydrat bekannt.[5]
Verwendung
Natriumiodat wird als Konservierungsmittel in der Lebensmittelindustrie und als Zusatzstoff in iodiertem Speisesalz eingesetzt.
Siehe auch
- Kaliumiodat
- Natriumperiodat NaIO4
Einzelnachweise
- Datenblatt Sodium iodate, ≥99% bei Sigma-Aldrich, abgerufen am 29. Januar 2017 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Inorganic Compounds, S. 4-90.
- Eintrag zu Natriumiodat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- I. Náray-Szabó, J. Neugebauer: The Crystal Structure of Sodium Iodate. In: J. Am. Chem. Soc. 1947, 69 (6), S. 1280–1283. doi:10.1021/ja01198a016.
- H. Miyamoto, M. Salomon: Alkali Metal Halates, Ammonium Iodate & Iodic Acid Solubility Data Series. Elsevier, 2013, ISBN 978-1-4832-8606-8, S. 330 (eingeschränkte Vorschau in der Google-Buchsuche).

