Iodchlorid
Iodchlorid (auch Iodmonochlorid) ist eine Interhalogenverbindung, die aus den Elementen Iod und Chlor besteht. Es wurde 1814 von Humphry Davy sowie unabhängig auch von Gay-Lussac entdeckt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
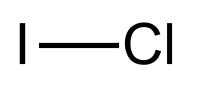 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Iodchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | ICl | ||||||||||||||||||
| Kurzbeschreibung |
rotbraunes Öl bzw. rubinrote nadelförmige Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 162,36 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
| ||||||||||||||||||
| Dichte |
3,1 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
94,4 °C (Zersetzung)[3] | ||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−23,8 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Iodchlorid lässt sich aus den Elementen oder durch Kochen von Iod in Königswasser herstellen.[1]
Eigenschaften
Iodchlorid zersetzt sich in Wasser zu Chlorwasserstoff, Iodsäure und Iod.[1] Die feste α-Form riecht stechend und ist wenig hygroskopisch, sie bildet rubinrote Nadeln. Die metastabile β-Form liegt in Form von braunroten, rhombischen Tafeln vor.[3]
Verwendung
Iodchlorid lässt sich zur Iodierung[4] verwenden. Mit einer essigsauren Iodchlorid-Lösung lässt sich außerdem die Iodzahl bestimmen (Wijs-Methode).[1]
Sicherheitshinweise
Iodchlorid ist allgemein ätzend, die Dämpfe/Aerosole verursachen Husten, Atemnot und Schleimhautreizungen. Die niedrigste bekannte letale Dosis beträgt oral bei Ratten 50 mg/kg Körpergewicht, beziehungsweise 500 mg/kg bei der Aufnahme durch die Haut.[5]
Einzelnachweise
- Eintrag zu Iodchloride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Juni 2015.
- Eintrag zu Iodchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Januar 2020. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 465.
- V. H. Wallingford and Paul A. Krueger: 5-Iodoanthranilic Acid In: Organic Syntheses. 19, 1939, S. 52, doi:10.15227/orgsyn.019.0052; Coll. Vol. 2, 1943, S. 349 (PDF).
- Datenblatt Iodchlorid (PDF) bei Merck, abgerufen am 19. Januar 2011.

