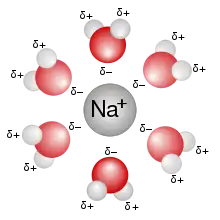
Wässrige Lösung
Eine wässrige Lösung bezeichnet die Lösung eines beliebigen hydrophilen Stoffes, oft eines Salzes, in Wasser.
Dass ein Stoff in Wasser gelöst ist, wird in der Summenformel und in Reaktionsgleichungen durch ein angehängtes, tiefgestelltes „(aq)“ (von lat. ‚aqua‘ Wasser) angezeigt, beispielsweise Cl−(aq) für gelöste Chlorid-Ionen. Anhand ihrer Löslichkeit werden Stoffe auch in zwei Gruppen eingeteilt: hydrophile („wasserliebende“; z. B. Natriumchlorid) und hydrophobe („wassermeidende“; z. B. Öle) Stoffe; allgemein gilt: Ionen und stark polare Stoffe lassen sich besser in Wasser lösen, als schwachpolare Stoffe, da Wasser ein Dipol ist, das heißt, dass Wassermoleküle eine positiv und eine negativ geladene Seite haben. Aus demselben Grund lassen sich von unpolaren Stoffen nur Spuren in Wasser lösen; dennoch können auch diese Spuren bereits so groß sein, dass sie sich bemerkbar machen, was zum Beispiel bei Öl verheerende Folgen haben kann.
Beim Lösen wird hierbei meist die Hydratisierungsenergie frei, obwohl andere Reaktionen, bei Salzen vor allem das Auflösen des Ionengitters, unter Umständen die Energiebilanz sogar in den negativen Bereich bringen können.
Eine wichtige Eigenschaft vieler wässriger Lösungen ist, dass sie den elektrischen Strom gut leiten, während Reinstwasser ein sehr schlechter Leiter (5.5·10−6 S/m) ist.[1]
Siehe auch
Einzelnachweise
- Elektrische Leitfähigkeit des Wassers. In: lenntech.de. Abgerufen am 10. Januar 2022.