Reinecke-Salz
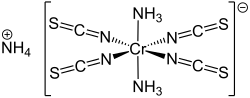
Das Reinecke-Salz ist eine Komplexverbindung des dreiwertigen Chroms mit der Konstitutionsformel NH4[Cr(SCN)4(NH3)2]. Es bildet dunkelrote Kristalle, die in heißem Wasser und Ethanol löslich sind.[2] Das Salz wurde erstmals 1863 von Albert Reinecke aus Detmold[4] durch Zusammenschmelzen von Ammoniumthiocyanat und Kaliumdichromat hergestellt.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Reinecke-Salz | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | NH4[Cr(SCN)4(NH3)2][1] | ||||||||||||||||||
| Kurzbeschreibung |
dunkelrote Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
268–272 °C (Zersetzung)[3] | ||||||||||||||||||
| Löslichkeit |
löslich in heißem Wasser und Ethanol[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Das Salz besteht aus einem Ammoniumion und einem Komplexanion, welcher aus einem Cr3+-Ion als Zentralatom und sechs Liganden besteht. Der Komplex ist oktaedrisch koordiniert.[6]
 Reinecke-Salz |
 Mit Reinecke-Salz gefälltes Hg2+ bildet einen flockigen rosafarbenen Niederschlag. |
Verwendung
Das Reinecke-Salz wird in der Analytik zum Nachweis von Kationen verwendet.[7] Beispielsweise fällt mit Quecksilber(II)-ionen ein schwerlöslicher hellroter Niederschlag von sogenanntem Quecksilber(II)-Reineckat aus:
Kupfer(I)-ionen bilden einen gelben schwerlöslichen Niederschlag:
Der Nachweis mit Reinecke-Salz ist sehr empfindlich. So lässt sich diese Methode auch zur quantitativen Bestimmung über die Photometrie benutzen. Fällt man beispielsweise Quecksilber(II)-Reineckat in Gegenwart von Thioharnstoff, so entsteht ein Komplex, der in Ketonen löslich ist und der sich bei 520–540 nm photometrieren lässt.[8]
Neben anorganischen Kationen sind inzwischen eine Vielzahl von Reaktionen mit organischen Kationen bekannt, insbesondere mit Ammoniumionen von primären und sekundären Aminen.[9]
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Inorganic Compounds, S. 4-48.
- Eintrag zu Reinecke-Salz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- Datenblatt Ammoniumtetrathiocyanatodiamminchromat(III) bei AlfaAesar, abgerufen am 8. Mai 2017 (PDF) (JavaScript erforderlich).
- Akademie der Wissenschaften in Göttingen (Hrsg.): Nachrichten von der Königl. Gesellschaft der Wissenschaften und der Georg-Augusts-Universität zu Göttingen. Dieterichsche Verlagsbuchhandlung, Göttingen 1867, S. 394 (Volltext in der Google-Buchsuche).
- Albert Reinecke: Über Rhodanchromammonium-Verbindungen. Annalen der Chemie und Pharmazie, Band 126, Seiten 113–118 (1863). doi:10.1002/jlac.18631260116.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1452.
- Jander-Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 5. Auflage, S. Hirzel, Stuttgart-Leipzig 1965, S. 263, 272.
- Bruno Lange, Zdenĕk J. Vejdĕlek: Photometrische Analyse. Verlag Chemie Weinheim 1980, S. 222.
- Tim Peppel, Christin Schmidt, Martin Köckerling: Synthesis, Properties, and Structures of Salts with the Reineckate Anion, [CrIII(NCS)4(NH3)2]−, and Large Organic Cations. Zeitschrift für anorganische und allgemeine Chemie 2011, 637, 1314–1321, doi:10.1002/zaac.201100091.

