Chromate
Chromate sind Salze der Chromsäure (H2CrO4). Das Chromat-Anion CrO42− hat eine gelbe Farbe und eine tetraedrische Struktur. Das Dichromat-Anion (Cr2O72−) hat eine orange Farbe und ist aus zwei verzerrten, eckenverknüpften Tetraedern aufgebaut. Zwischen Chromaten und Dichromaten besteht in wässrigen Lösungen ein pH-abhängiges chemisches Gleichgewicht, das dem Prinzip vom kleinsten Zwang gehorcht[1]:
| Chromate | |
|---|---|
 Chromat-Anion | 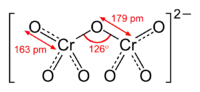 Dichromat-Anion |
 Kaliumchromat-Kristalle |  Kaliumdichromat-Kristalle |
Unter sehr sauren Bedingungen und konzentrierten Lösungen bilden sich in einer analogen Reaktion die eher rötlichen Trichromate (Cr3O102−), Tetrachromate (Cr4O132−) und tiefrote Polychromate (CrnO3n+12−).[1]
Alle Chromate sind – besonders unter sauren Bedingungen – starke Oxidationsmittel.[1]
Verwendung und Sicherheitshinweise
Chromate finden teilweise Verwendung als Korrosionsschutzmittel (Pigmente, siehe auch Rostumwandler und Chromatieren).[1]
Viele Chromate haben eine intensive Färbung, deshalb werden (oder wurden) sie als farbgebender Bestandteil in Malerfarbe verwendet, beispielsweise „Chromgelb“ (PbCrO4).[1]
Chromate finden Verwendung in der analytischen Chemie, wo sie als Fällungsreagenzien verwendet werden.
In der organischen Chemie benutzt man Chromate beispielsweise zur Oxidation von Alkoholen. Bekannt ist hierbei das Jones-Reagenz aus Chrom(VI)-oxid, konzentrierte Schwefelsäure und Aceton (Jones-Oxidation) zur Herstellung von Carbonsäuren und das Collins-Reagenz, mit welcher man die Oxidation des Alkohols auf der Stufe des Aldehyds anhalten kann.[2]
Alle Chromate und andere Chrom(VI)-verbindungen (mit Ausnahme des wasserunlöslichen Bariumchromats) sind stark giftig, wassergefährdend und krebserzeugend (karzinogen); Beispiele sind etwa Ammoniumdichromat, Kaliumdichromat, Natriumchromat, Lithiumchromat, Zinkchromat, Strontiumchromat und Chrom(III)-chromat.
Siehe auch
Einzelnachweise
- Wiberg, Egon., Wiberg, Nils: Lehrbuch der anorganischen Chemie. 102., stark umgearbeitete und verb. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Greeves, Nick,, Warren, Stuart G. 1938-: Organische Chemie. 2. Auflage. Springer, Berlin 2013, ISBN 978-3-642-34715-3.