Kaliumtetraperoxochromat
Kaliumtetraperoxochromat ist eine chemische Verbindung aus der Gruppe der Chromate.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
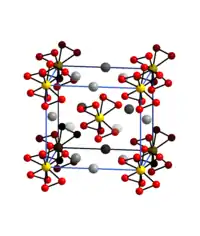 | |||||||
| _ Cr5+ _ K+ _ O− | |||||||
| Kristallsystem | |||||||
| Raumgruppe |
I42m (Nr. 121) | ||||||
| Gitterparameter | |||||||
| Allgemeines | |||||||
| Name | Kaliumtetraperoxochromat | ||||||
| Andere Namen |
Kalium-tetraperoxochromat(V) | ||||||
| Verhältnisformel | K3CrO8 | ||||||
| Kurzbeschreibung |
rotbrauner Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 297,3 g·mol−1 | ||||||
| Aggregatzustand |
fest[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Kaliumtetraperoxochromat kann durch Reaktion von Kaliumhydroxid, Chrom(VI)-oxid und Wasserstoffperoxid gewonnen werden.[2]
Es kann auch durch Reaktion von Kaliumchromat mit Kaliumhydroxid und Wasserstoffperoxid hergestellt werden.[4]
Eigenschaften

Kaliumtetraperoxochromat bildet tief rotbraune oktaedrische Kristalle, die mäßig löslich in kaltem Wasser und unlöslich in Alkohol und Ether sind und beim Erhitzen auf 170 °C explodieren.[5] Das Salz ist längere Zeit ohne Zersetzung haltbar, kann jedoch spontan explodieren.[2] Die Kristallstruktur (tetragonal, Raumgruppe I42m (Raumgruppen-Nr. 121)) enthält Tetraperoxochromat(V)-Ionen, in denen jedes Chromatom durch acht Sauerstoffatome koordiniert ist.[6]
Um die Chelatkomplexion durch die Peroxidanionen zu verdeutlichen, wird die Formel häufig auch als K3[Cr(O2)4] notiert.
Verwendung
Kaliumtetraperoxochromat(V) kann zur Erzeugung von Singulett-Sauerstoff dienen.[7][8] Es wurde auch zum Auslösen von Arthritis bei Mäusen eingesetzt.[9]
Einzelnachweise
- R. Stomberg: Least-squares refinement of the crystal structure of potassium peroxochromate. In: Acta Chemica Scandinavica, 1963, 17, S. 1563–1566 doi:10.3891/acta.chem.scand.17-1563.
- Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band III. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1528.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- J. Derek Woollins: Inorganic Experiments. John Wiley & Sons, 2010, ISBN 978-3-527-32472-9, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jander-Blasius, Lehrbuch der analytischen und präparativen anorganischen Chemie, 8. Auflage, S. Hirzel Verlag Stuttgart, 1969
- R. M. Wood, K. A. Abboud, R. &C. Palenik, G. J. Palenik: Bond valence sums in coordination chemistry. Calculation of the oxidation state of chromium in complexes containing only Cr-O bonds and a redetermination of the crystal structure of potassium tetra(peroxo)chromate(V). In: Inorganic Chemistry, 2000, 39, S. 2065–2068 (doi:10.1021/ic990982c).
- Eintrag zu Kaliumchromat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Juli 2018.
- E. K. Hodgson, I. Fridovich: Production of superoxide radical during the decomposition of potassium peroxochromate(V). In: Biochemistry. 13, 2002, S. 3811, doi:10.1021/bi00715a030.
- Ralf Miesel, Hans Kröger, Maciej Kurpisz, Ulrich Weser: Induction of Arthritis in Mice and Rats by Potassium Peroxochromate and Assessment of Disease Activity by Whole Blood Chemiluminescence and pertechnetate-Imaging . In: Free Radical Research. 23, 2009, S. 213, doi:10.3109/10715769509064035.