Chrom(III)-fluorid
Chrom(III)-fluorid ist eine chemische Verbindung des Chroms und zählt zu den Fluoriden. Neben der wasserfreien Verbindung existieren auch verschiedene Hydrate.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| _ Cr3+ _ F− | ||||||||||
| Allgemeines | ||||||||||
| Name | Chrom(III)-fluorid | |||||||||
| Andere Namen |
Chromfluorid | |||||||||
| Verhältnisformel | CrF3 | |||||||||
| Kurzbeschreibung |
flüchtiger, grüner Feststoff mit stechendem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 108,99 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
3,8 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
schwer löslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Darstellung
Chrom(III)-fluorid erhält man durch Reaktion von Chrom(III)-oxid und Fluorwasserstoff:[2]
Die wasserfreie Form erhält man aus Fluorwasserstoff und Chrom(III)-chlorid:[3]
Eigenschaften
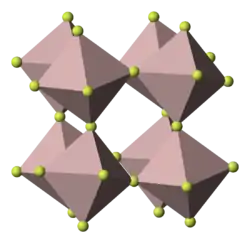
Chrom(III)-fluorid ist ein grüner kristalliner Feststoff, der in gängigen Lösungsmitteln unlöslich ist, dessen farbigen Hydrate [Cr(H2O)6]F3 und [Cr(H2O)3]F3 · 3 H2O jedoch wasserlöslich sind. Das Trihydrat ist grün, das Hexahydrat ist violett. Die wasserfreie Verbindung sublimiert bei 1100–1200 °C. Wie fast alle Chrom(III)-Verbindungen hat Chrom(III)-fluorid oktaedrische Chrom-Zentren. In der wasserfreien Form werden die sechs Koordinationsstellen durch Fluor besetzt. In den Hydraten sind einige oder alle der Liganden durch Wasser ersetzt.[4] Die wässrige Lösung der Hydrate reagiert stark sauer, und ab 60 °C beginnt die Kristallwasserabspaltung der Hydrate.[1]
Wasserfreies Chrom(III)-fluorid kristallisiert trigonal, Raumgruppe R3c (Raumgruppen-Nr. 167) mit den Gitterparametern a = 4,986 Å und c = 13,21 Å.[5] Das Trihydrat kristallisiert trigonal in der Raumgruppe R3m (Nr. 166) mit den Gitterparametern aR = 5,668 Å und αR = 112,5° sowie einer Formeleinheit pro Elementarzelle. Das Pentahydrat kristallisiert orthorhombisch in der Raumgruppe Pbcn (Nr. 60) mit den Gitterparametern a = 10,396 Å, b = 8,060 Å und c = 7,965 Å sowie vier Formeleinheiten pro Elementarzelle.[4]
Verwendung
Chrom(III)-fluorid findet relativ wenig Verwendung, darunter als Korrosionsinhibitor in Rostschutzfarben, für das Beizen von Wolle und Cellulosefasern und Färben mit Beizenfarbstoffen.[1]
Einzelnachweise
- Eintrag zu Chrom(III)-fluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger: Chromium Compounds in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005; doi:10.1002/14356007.a07_067.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1998, ISBN 3-527-26169-9, S. 1312.
- Frank H. Herbstein, Moshe Kapon, George M. Reisner: Crystal structures of chromium(III) fluoride trihydrate and chromium(III) fluoride pentahydrate. Structural chemistry of hydrated transition metal fluorides. Thermal decomposition of chromium(III) fluoride nonahydrate, In: Zeitschrift für Kristallographie, 1985, 171 (3–4), S. 209–224; doi:10.1524/zkri.1985.171.3-4.209.
- J.-E. Jørgensen, W.G. Marshall, R.I. Smith: The compression mechanism of CrF3. In: Acta Crystallographica, B60, 2004, S. 669–673, doi:10.1107/S010876810402316X.

