Alkine
Alkine (früher Acetylene und Acetylenkohlenwasserstoffe) sind chemische Verbindungen aus der Gruppe der aliphatischen Kohlenwasserstoffe, die an beliebiger Position mindestens eine Kohlenstoff-Kohlenstoff-Dreifachbindung (R–C≡C–R) im Molekül besitzen.[1] Die Alkine mit nur einer solchen Dreifachbindung bilden eine homologe Reihe mit der allgemeinen Summenformel CnH2n−2 (mit n = 2, 3, 4, …), die mit Ethin beginnt.
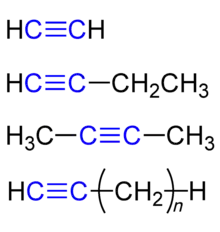
Verbindungen mit zwei oder mehreren Kohlenstoff-Kohlenstoff-Dreifachbindungen werden Polyine genannt; im erweiterten Sinne können acyclische Kohlenwasserstoffe mit mehreren Kohlenstoff-Kohlenstoff-Dreifachbindungen zu den Alkinen gezählt werden.[2]
Cyclische Verbindungen mit einer Kohlenstoff-Kohlenstoff-Dreifachbindung werden hingegen zu den Cycloalkinen gezählt und aromatische Kohlenwasserstoffe mit formaler Dreifachbindung im Ring Arine genannt.
Geschichte
Zum ersten Mal wurde Acetylen (Ethin), das einfachste Alkin, im Jahr 1836 von Edmund Davy erhalten, einem Chemieprofessor an der Royal Dublin Society und Vetter des berühmten englischen Chemikers Humphry Davy. Beim Versuch, Kalium in metallischer Form darzustellen, erhielt er Ethin durch Erhitzen von Kaliumsalzen wie Kaliumacetat oder Kaliumcarbonat mit Kohle, gefolgt von der Reaktion des gebildeten Kaliumcarbids mit Wasser. Die Entdeckung geriet jedoch in Vergessenheit. Im Jahr 1862 gelang dem deutschen Chemiker und Arzt Friedrich Wöhler die Darstellung von Acetylen durch die Reaktion von Wasser mit Calciumcarbid. Im Jahr 1863 gelang dem französischen Chemiker Marcelin Berthelot die Darstellung aus den Elementen über den Lichtbogen zwischen Graphitelektroden in einer Wasserstoffatmosphäre. Er gab dem Gas den Namen Acetylen. 1895 entdeckte Henry Le Chatelier, dass Acetylen mit Sauerstoff mit einer sehr heißen Flamme verbrennt. Damit war die Grundlage des Acetylen-Schweißens und -Schneidens gelegt.
Homologe Reihe
Hier die wichtigsten Alkine von Ethin (C2H2) (Acetylen) bis Decin (C10H18) mit Namen und Summenformel:
Nomenklatur
Die Benennung der Alkine nach den IUPAC-Regeln orientiert sich an den Namen für die Alkane. Als Stammnamen für das Alkin wählt man den Wortstamm des Alkans mit gleicher Anzahl an Kohlenstoffatomen und ersetzt die Endsilbe -an durch -in. Bei verzweigten Alkinen gibt die längste mögliche Kohlenstoffkette mit der Dreifachbindung den Stammnamen. Alkine haben eine höhere Priorität als Alkene. Die ersten beiden Vertreter der homologen Reihe dieser Stoffgruppe sind Ethin (H–C≡C–H) und Propin (H–C≡C–CH3). Die Lage der Dreifachbindung wird mit einer vorgestellten Zahl beschrieben, so dass diese möglichst klein ist z. B. 1-Butin (H–C≡C–CH2–CH3) und 2-Butin (H3C–C≡C–CH3). Enthält die Kohlenstoffkette mehrere Dreifachbindungen, so fügt man im Namen vor der Silbe in die Silbe di, tri, tetra usw. ein. So erhält ein Alkin mit fünf (griechisch penta) C-Atomen und zwei Dreifachbindungen nach dem 1. und 4. C-Atom den IUPAC-Namen 1,4-Pentadiin (H–C≡C–CH2–C≡C–H). Das strukturisomere 1,3-Pentadiin hat demnach folgende Struktur: H–C≡C–C≡C–CH3.
Elektronische Struktur
Die Dreifachbindung der Alkine besteht aus einer sp-Hybridbindung und zwei orthogonalen p-Bindungen. Diese beiden orthogonalen p-Bindungen (Orthonormalbasis) bilden zwei Rotations-invariante Orbitale, welche sich z. B. durch IR-spektroskopische Untersuchungen an W2(CO)6 nachweisen lässt. Durch den höheren Anteil an s-Orbitalen in den sp-Hybridorbitalen ist die Aufenthaltswahrscheinlichkeit der Elektronen der C-H-Bindung in der Nähe des Kohlenstoff-Kerns größer als bei Alkenen (sp2) und Alkanen (sp3), worauf die CH-Acidität endständiger (terminaler) Alkine beruht. Daher ist der pKS-Wert von Ethin mit 25 deutlich kleiner als der von Ethen (44) bzw. Ethan (50). Mit starken Basen können bei niederen Alkinen ein endständiges C-Atom deprotoniert werden und z. B. durch ein Metallatom ersetzt werden. Salze der Alkine werden Acetylide genannt. Abgesehen von der schwachen C-H-Polarität aufgrund verkürzten C-H-Bindung, sind Alkine relativ unpolar. Aus der elektronischen Struktur der C≡C-Dreifachbindung folgt, dass die C-Atome der Dreifachbindung und die beiden direkt mit diesen C-Atomen verknüpfte Atome in einer Linie (linear) ausgerichtet sind. Der Kohlenstoff-Kohlenstoff-Abstand einer Dreifachbindung liegt bei 120 pm und ist damit kürzer als der Abstand einer C=C-Doppelbindung.
Spektroskopische Eigenschaften
1H-NMR
Im 1H-NMR sind Alkinyl-Wasserstoffatome nicht so stark entschirmt wie Alkenylwasserstoffatome, da in der rotations-symmetrischen Dreifachbindung durch das äußere Magnetfeld ein Ringstrom induziert wird, dessen Magnetfeld dem äußeren entgegengesetzt ist. Da die Dreifachbindung die Spin-Spin-Kopplung gut überträgt, haben die 4J-Kopplungen über vier Bindungen sowie die 5J-Kopplungen über fünf Bindungen für gewöhnlich Kopplungskonstanten von 1 bis 3 Hz. Für Fernkopplungen ist das ein relativ hoher Wert, daher ist er für die Alkinylgruppe oft charakteristisch.
Infrarotspektroskopie
Die Infrarotspektroskopie ist neben der 13C-NMR-Spektroskopie eine nützliche Methode zur Identifizierung eines endständigen Alkins, da sich bei etwa 2100 cm−1 eine starke charakteristische Bande für die C-C-Valenzschwingung zeigt.
Gewinnung und Darstellung von Ethin
- Gewinnung und anschließende Hydrolyse von Calciumcarbid
- Dimerisierung und Dehydrierung von Methan
- Partielle Methanoxidation
Reaktionen
Hydrierung mit normalem Katalysator
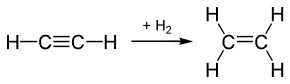
Alkine können mit Hilfe üblicher Katalysatoren wie Platin oder Palladium mit Wasserstoff zu Alkanen hydriert werden.
Hydrierung mit vergiftetem Katalysator
Mit einem vergifteten Katalysator, dem Lindlar-Katalysator, reagiert das Alkin nur zum Alken. Dabei entstehen ausschließlich (Z)-Alkene (cis), da sich die Wasserstoffatome von der gleichen Seite an das Alkin nähern und reagieren.
Bildung von Alkinyliden
Da endständige Alkine, wie schon erwähnt, CH-Säuren sind, können sie zu den sogenannten Alkinyliden reagieren. Mit Alkalimetallen bilden sie in flüssigem Ammoniak die Alkalialkinylide. In wässrigen Lösungen von Silber(I)- und Kupfer(I)-Salzen entstehen dabei die unlöslichen Schwermetallalkinylide. Diese sind jedoch, in getrocknetem Zustand, hochexplosiv!
Elektrophile Addition
Die Addition an eine Dreifachbindung ist im Vergleich zur Addition an eine Doppelbindung stärker exotherm.
Trotzdem sind Alkine gegenüber elektrophilen Reagenzien weniger reaktiv als Alkene. Den scheinbaren Widerspruch kann man durch die Stabilität der intermediären Carbenium-Kationen erklären:
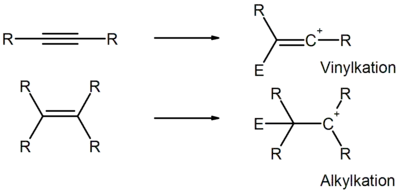
Das Alkylkation ist wesentlich stabiler als ein Vinylkation, die Additionsreaktion von Elektrophilen an Alkine ist somit kinetisch gehemmt (=höhere Aktivierungsenergie).
Halogenierung
Nach der hallabschen Methode wird die Halogenierung folgendermaßen angewandt: Die C-C-Dreifachbindung ist weniger nukleophil als die Kohlenstoff-Kohlenstoff-Doppelbindung, weshalb die Halogene nicht spontan an die Dreifachbindung addieren. Dies geschieht erst durch eine Aufpolarisierung der Halogen-Halogen-Bindung mithilfe einer Lewis-Säure, zum Beispiel FeCl3 oder AlCl3. Hierbei entsteht, stereoselektiv, das (E)-1,2-Dihalogenalken.
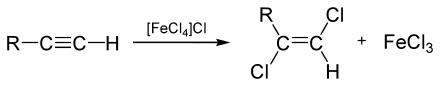
Deshalb lässt sich in Gegenwart einer Kohlenstoff-Kohlenstoff-Dreifachbindung die Kohlenstoff-Kohlenstoff-Doppelbindung selektiv halogenieren, sofern keine Lewis-Säure hinzugegeben wird.
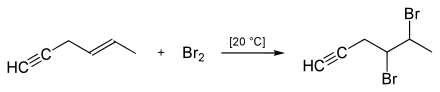
Hydrohalogenierung
An Alkine kann Halogenwasserstoff in der ersten Stufe zu vinylogenen Halogenalken addiert werden. Diese reagieren aber nur unter drastischeren Bedingungen weiter zu den Dihalogenen, da diese wenig reaktiv sind. Hierbei entstehen, nach der Markownikoff-Regel 1,1-Dihalogenalkane.
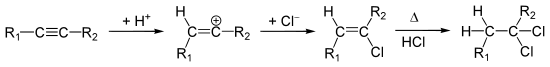
Die Hydrochlorierung von Ethin zum Vinylchlorid war von großer technischer Bedeutung, da Vinylchlorid der monomere Baustein zur Herstellung von PVC ist.
Hydratisierung
Wasser addiert, in Gegenwart von Katalysatoren in saurer Umgebung an Ethin zum Ethenol. Diese tautomere Form lagert schließlich zum Acetaldehyd um (Keto-Enol-Tautomerie).
Endständige Alkine lagern hingegen nach der Hydratisierung (auch hier nach der Markownikoff-Regel) zu den Methylketonen um.
Natürliche Vorkommen

Alkine sind in der Natur nicht sehr verbreitet (lediglich 1000 Verbindungen sind bekannt) und davon sind auch nur einige wenige physiologisch im eigenen Organismus aktiv. Die übrigen wirken meist als Fungizide oder als Verteidigungsgift oder Schleimhaut-Reiz-Stoff. Die Haut der Pfeilgiftfrösche beispielsweise sezerniert Histrionicotoxin, eine Substanz, die zwei Alkingruppen enthält und den Frosch vor Säugetieren und Reptilien schützt. Eine große Gruppe von biologisch aktiven Alkinen bilden die Endiin-Antibiotika. Naturstoffe, die als Strukturmotiv die Endiin-Einheit besitzen, wirken häufig cytotoxisch gegenüber menschlichen Tumorzelllinien und stellen somit potentielle Chemotherapeutika dar. Ein Beispiel hierfür ist das von Streptomyces carcinostaticus sezernierte Neocarzinostatin.
Bedeutung
Von technischer Bedeutung sind lediglich Ethin (Trivialname Acetylen) und Propin, sie werden unter anderem als Schweißgas verwendet, da die Flammen dieser extrem heiß (bis 3100 °C) werden. Ethin ist in der chemischen Industrie von hoher Bedeutung zur Herstellung von vielen weiteren Verbindungen wie etwa Acrylsäure oder Acrylamid. Auch 2-Butin-1,4-diol ist ein Vorläufer für die Herstellung von Tetrahydrofuran (THF).
Literatur
- Allinger, Cava, de Jongh, Johnson, Lebel, Stevens: Organische Chemie, 1. Auflage, Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X, S. 259–269.
- Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 91–100.
- Morrison / Boyd: Lehrbuch der Organischen Chemie, 3. Auflage, Verlag Chemie, Weinheim 1986, ISBN 3-527-26067-6, S. 629–648.
- Streitwieser / Heathcock: Organische Chemie, 1. Auflage, Verlag Chemie, Weinheim 1980, ISBN 3-527-25810-8, S. 363–383.
- K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie, 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8, S. 631–661.
Weblinks
Einzelnachweise
- Eintrag zu alkynes. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00236 – Version: 2.3..
- Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg 2001.