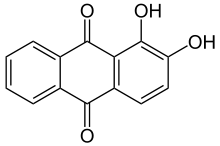
Alizarin
Alizarin (Wortbildung von Jean-Jacques Colin und Pierre-Jean Robiquet aus der Bezeichnung Alizari für die aus dem Orient importierten Wurzeln der Rubia tinctorum, d. h. Färberkrapp;[6][7] abgeleitet vom arabischen al-ʿaṣāra „ausgepresster Saft, Extrakt“)[8] ist eine orangegelbe, natürlich vorkommende chemische Verbindung aus der Gruppe der Anthrachinone. In der Natur kommt Alizarin glycosidisch an das Disaccharid Primverose gebunden in der Wurzel des Färberkrapps und anderer Rötegewächse vor. Alizarin ist die Stammverbindung der Alizarinfarbstoffe, deren Struktur eng mit der des Alizarins verwandt ist.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Alizarin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C14H8O4 | ||||||||||||||||||
| Kurzbeschreibung |
orangegelbe Nadeln oder Prismen[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 240,20 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,1725 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
430 °C (Sublimation)[2] | ||||||||||||||||||
| pKS-Wert |
6,77[4] | ||||||||||||||||||
| Löslichkeit |
in siedendem Wasser sehr wenig, in Alkoholen, Ether, aromatischen Kohlenwasserstoffen und Eisessig löslich[2] | ||||||||||||||||||
| Brechungsindex |
1,5190[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
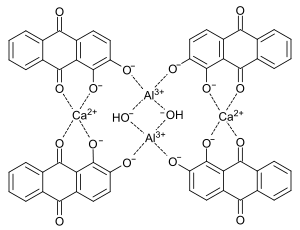
Alizarin bildet mit verschiedenen Metallkationen rote bis rotviolette Komplexe, sogenannte Lacke. Dies sind Pigmente hoher Farbstärke, die schwerlöslich in Wasser sind. Diese wurden schon in prähistorischer Zeit zum Einfärben von Textilien verwendet, mit dem als „Türkischrot“ bekannten Alizarin-Aluminium-Calciumkomplex wurde früher Wolle und Seide rot gefärbt.
Bis in die zweite Hälfte des 19. Jahrhunderts wurde es aus pflanzlichen Quellen gewonnen. Zu dieser Zeit führten Carl Graebe und Carl Liebermann eine Reihe von Studien durch, in denen sie 1868 die chemische Struktur des Alizarins bestimmten und darauf aufbauend Synthesewege entwickelten.[6] Alizarin war der erste natürliche Farbstoff, der synthetisch im industriellen Maßstab hergestellt wurde, und er war lange Zeit ein bedeutender Beizenfarbstoff.
Geschichte
Altertum bis Späte Neuzeit

Krapp wurde bereits 1500 v. Chr. in Zentralasien und Ägypten angebaut und als roter Farbstoff verwendet.[9] Mit Alizarin gefärbte Stoffe befanden sich im Grab von Tutanchamun und wurden in Pompeji und Korinth nachgewiesen. Um 330 v. Chr. verwendete Alexander der Große der Legende nach Alizarin bei einer Schlacht gegen ein größeres persisches Heer. Er ließ die Gewänder der Soldaten zum Teil mit Alizarin rot färben, um damit den Eindruck blutdurchtränkter Kleidung zu vermitteln. Der Anblick der vermeintlich verwundeten Soldaten veranlasste die Perser zu einem unvorsichtigen Angriff, die damit in die von Alexander gestellte Falle tappten.[10] Karl der Große förderte um 800 den Anbau von Krapp als Färberpflanze.[11]
Im 13. und 14. Jahrhundert führte das Verfahren der Türkischrotfärbung Kleinasien zu hoher Blüte. Wolle und Seide wurde dabei in einer mehrere Wochen dauernden Behandlung mit Hilfe von Kreide- und Alaunaufschlämmungen gebeizt und mit Färberkrapp gefärbt. Die zu färbenden Stoffe wurden weiterhin mit einer Aufschwemmung von getrocknetem Kuh- und Schafsmist behandelt.[12]
Die Möglichkeit zur biologischen Färbung wurde erstmals 1567 festgestellt, als beobachtet wurde, dass bei einer Verfütterung an Tiere deren Zähne und Knochen rot gefärbt wurden. Im Europa des 17. Jahrhunderts wurde Alizarin vielfältig verwendet, unter anderem in England als roter Farbstoff für die Kleidung der parlamentarischen New Model Army, was englischen und späteren britischen Soldaten den Spitznamen Redcoats gab.[13] Um die einheimischen Färber und Pflanzer zu unterstützen, ordnete Louis-Philippe I. 1840 an, die Kleidung der französischen Armee mit Krapp rot zu färben.[10]
Strukturaufklärung und Synthese gegen Mitte des 19. Jahrhunderts
Das Alizarin wurde im Jahr 1826 von Jean-Jacques Colin und Pierre-Jean Robiquet aus der Krappwurzel isoliert.[14] Es findet sich im Krapp in Gestalt eines Glykosids, der sogenannten Ruberythrinsäure, welche von Friedrich Rochleder zuerst in reinem Zustand dargestellt wurde.[15]
Carl Graebe und Carl Liebermann arbeiteten ab 1868 an der Strukturaufklärung des Alizarins. Die Destillation über Zink/Zinkoxid lieferte Anthracen und vier Äquivalente Wasser.[16] Mit dieser Methode hatte Adolf von Baeyer schon die strukturelle Verwandtschaft von Anthrachinon und Anthracen aufgeklärt.[17] Da Alizarin mit Essigsäureanhydrid ein Diacetat bildete, sollte es sich um eine Dihydroxyverbindung des Anthrachinons handeln. Es blieb die Frage nach der Stellung der beiden Hydroxygruppen.
Die Oxidation von Alizarin führte zum Phthalsäureanhydrid, daher sollte einer der Benzolringe unsubstituiert sein. Die Frage der Stellung der beiden Hydroxygruppen klärten Heinrich Caro und von Baeyer. Durch die Synthese des Alizarins aus Phthalsäureanhydrid und Brenzcatechin konnten sie zeigen, dass die beiden Hydroxygruppen ortho-ständig waren.[17] Caro und Baeyer entwickelten eine zweite Synthese durch Bromierung von Anthrachinon und anschließender Umsetzung in der Kaliumhydroxid-Schmelze. Basierend auf diesen Arbeiten entwickelten Liebermann und Graeve schließlich eine kommerziell konkurrenzfähige Synthese durch eine Sulfonierungs-Oxidation von Anthracen, einem bis dahin nicht genutzten Produkt aus Steinkohlenteer.[17]
Beginn der industriellen Produktion
Liebermann und Graebe meldeten 1869 die Herstellung aus Anthracen am 23. März 1869 in Preußen, Frankreich und England zum Patent an. Heinrich Caro verbesserte zusammen mit Graebe das Verfahren bei der BASF, und am 25. Juni 1869 wurde den dreien für England das Patent auf das Sulfierungs- oder Sulfonisierungsverfahren erteilt. Nur einen Tag später versuchte der Konkurrent aus England, William Henry Perkin, dieses Verfahren patentieren zu lassen. Um Rechtsstreitigkeiten zu vermeiden, einigten sich Perkin und der BASF-Gründer Friedrich Engelhorn über die Produktion für den damals lukrativen englischen Markt. Kurze Zeit später meldeten J. Brönner und H. Gutzkow ein Patent zur Gewinnung von Anthracen aus Steinkohlenteer mittels Wasserdampfdestillation an, das für die weitere technische Entwicklung der Synthese von Alizarin von großer Bedeutung war.[18] Mit natürlichem Alizarin gefärbte Stoffe wiesen aufgrund des in der Krappwurzel vorhandenen Purpurins einen leicht anderen Farbton auf als Stoffe, die mit synthetisch produziertem Alizarin gefärbt wurden. Der bläulich-rote Farbton der Färbung mit Krapp biologischen Ursprungs ähnelt der Färbung des Diazofarbstoffs Acid Red 73 (C.I. 27290). Durch die Entwicklung der technischen Synthese des Alizarins wurde seine Gewinnung aus der Wurzel des Färberkrapps bedeutungslos. Ihr Anbau, der vor allem in Südfrankreich, im Elsass und in den Niederlanden verbreitet war, kam bis 1876 fast völlig zum Erliegen.[19] Alizarin stand bald im Wettbewerb mit anderen roten Farbmitteln, wie dem 1880 entwickelten Azofarbstoff Pararot.[20]
Im Jahr 1880 betrug die Produktion in England etwa 1400 Tonnen, der englische Bedarf lag bei 680 Tonnen.[21] Im Jahr 1983 wurden weltweit 150 Tonnen produziert, 1988 nur noch 19 Tonnen. Es wird meist für den Künstlerbedarf sowie spezielle Verpackungsdrucke hergestellt.[22]
Gewinnung und Darstellung
Gewinnung aus Färberkrappwurzeln

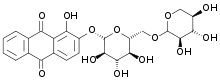

Die Gewinnung des Alizarins erfolgte aus den Wurzeln der dreijährigen Pflanze, wo es glycosidisch an der Ruberythrinsäure gebunden vorliegt.[23][24] Dazu konnte die frisch geerntete Wurzel mit Wasser übergossen und eingeweicht werden. Meist aber wurden die Wurzel getrocknet, geschält, zerkleinert und gemahlen. Die Aufspaltung der Ruberythrinsäure war zeitintensiv und konnte eine zweijährige Lagerung erfordern.[25] Die Ausbeute betrug etwa 5 bis 10 %, bezogen auf die Trockenmasse der Wurzeln, wobei die Wurzelrinde den höchsten Farbstoffgehalt aufweist. Wurzeln, deren Korkschicht entfernt wurde, sogenannter „beraubter“ Krapp, erzielten meist eine bessere Qualität. Neben Alizarin enthält die Wurzel verwandte Stoffe wie Purpurin, Pseudopurpurin, Rubiadin, Munjistin und Alizarin-β-methylether.[26]
Biosynthese
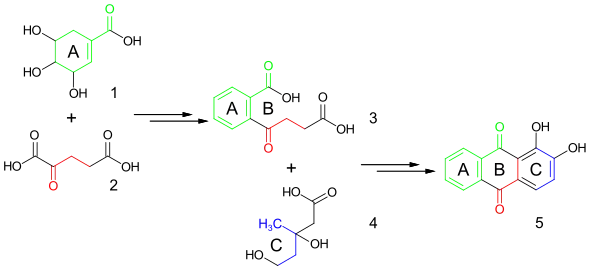
Versuche mit 14C-markierten Vorstufen zeigen, dass die Biosynthese von Alizarin (5) aus Shikimisäure (1), α-Ketoglutarsäure (2) und Mevalonsäure (4) erfolgt. Es wird angenommen, dass die Shikimisäure in die Chorisminsäure umgewandelt wird, welche mit der α-Ketoglutarsäure die 2-Succinylbenzoesäure[27] (3) ergibt. Diese cyclisiert zu einem Naphthalinderivat unbekannter Struktur – dabei könnte es sich um die 1,4-Dihydroxy-2-naphthoesäure[28] handeln. Es folgt eine Verknüpfung mit Dimethylallylpyrophosphat, das aus Mevalonsäure gebildet wird. Nach Decarboxylierung und Ringschluss führen weitere Schritte zum Alizarin. Der A-Ring des Alizaringerüst resultiert komplett aus der Shikimisäure, der B-Ring wird aus der α-Ketoglutarsäure gebildet und der C-Ring aus der Mevalonsäure.[29][30]
Synthese
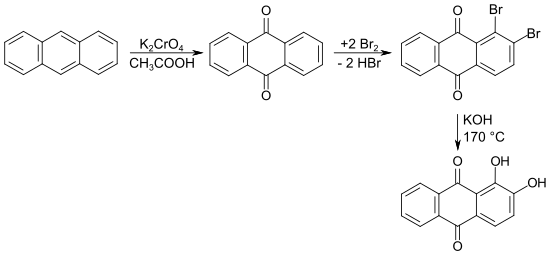
Die Erstsynthese von Graebe und Liebermann erfolgte über die Oxidation des Anthracens, etwa mit Salpetersäure oder Chromsäure, zum Anthrachinon.[31] Durch die Bromierung des Anthrachinons und anschließende Umsetzung mit Kaliumhydroxid in der Schmelze entstand das Dikaliumsalz des Alizarins, welches sich durch Ansäuern aus der wässrigen Lösung fällen ließ.[32][33]
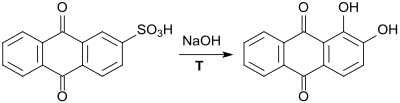
Technisch wird Alizarin durch eine Alkalischmelze der Anthrachinon-2-sulfonsäure[34] in Gegenwart von Oxidationsmitteln wie Natriumchlorat oder Natriumnitrat gewonnen, wobei nicht nur die Sulfonsäuregruppe abhydrolysiert, sondern eine zweite Hydroxygruppe in 1-Stellung eingeführt wird.[35]
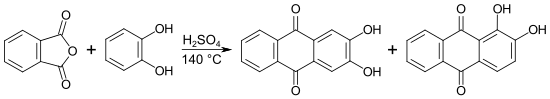
1874 veröffentlichten Baeyer und Caro eine Alizarinsynthese durch eine Schwefelsäure-katalysierte Friedel-Crafts-Acylierung von Phthalsäureanhydrid mit Brenzcatechin.[36] Liebermann konnte jedoch zeigen, dass bei dieser Umsetzung Alizarin nur als Nebenprodukt neben 2,3-Dihydroxyanthrachinon entsteht.[37]
Die Reaktion von 2-Chlorphenol mit Phthalsäureanhydrid bei 255 °C führt ebenfalls zur Bildung von Alizarin. Nach Umkristallisation in Ethanol beträgt die Ausbeute etwa 75 %.[38]
Eigenschaften
Alizarin kristallisiert in roten rhombischen Nadeln mit einem Schmelzpunkt von 289 °C und sublimiert in orangeroten Prismen. Der Siedepunkt liegt bei 430 °C.[39] Alizarin kristallisiert in zwei Strukturen. Beide Strukturen kristallisieren ohne Lösungsmittelanteile und sind stark ungeordnet. Eine Struktur kristallisiert in der monoklinen zentrosymmetrischen Raumgruppe P21/c mit den Gitterparametern a = 2005,9 pm, b = 368,50 pm, c = 2100,4 pm. Die zweite kristallisiert in der nicht-zentrosymmetrischen Raumgruppe Pc mit den Gitterparametern a = 813,19 pm, b = 371,02 pm, c = 1687,11 pm.[40]
Die Destillation über Zinkstaub führt zur Bildung von Anthracen.[17] Durch die Behandlung mit starken Oxidationsmitteln wird Phthalsäure erhalten. Mit Essigsäureanhydrid bildet es ein Diactetat.[41]
Alizarin weist als Chromophor ein chinoides System mit zwei tautomeren Grenzstrukturen auf. Die Hydroxygruppe bildet dabei mit der benachbarten Carbonylgruppe eine intramolekulare Wasserstoffbrückenbindung.[42]
Verwendung
Farbmittel

Alizarin haftet nur an Stoffen, wenn diese vorher gebeizt werden, etwa mit einer Lösung von Aluminiumsulfat oder Aluminiumacetat. Die Faser wird dazu vorher mit ranzigem Olivenöl (Altrotverfahren) oder mit Türkischrotöl (Neurotverfahren) behandelt, damit die Beize besser auf der Faser hält. Neben Aluminium finden Eisen(III)- und Chrom(III)-Beizen Verwendung, wobei der Eisenkomplex einen blau-violetten Farbton liefert. Alizarin ist über das Metallkation, das seinerseits wieder an die Carboxygruppen der Seiden- und Wollproteine gebunden ist, chemisch an die Faser gebunden.[26]
Alizarin bildet Salze mit verschiedenen Oxiden und Salzen von Metallen wie Calcium oder Aluminium, die als „Lack“ oder „Komplex“ bezeichnet werden. Der Begriff „Lack“ bezeichnet in der Farbstoffchemie ein schwer- oder unlösliches Salz eines wasserlöslichen Farbstoffs.[44] Der Ausdruck „Lack“ leitet sich vom sanskritischen Wort „Laksha“ ab, einer Bezeichnung der Lackschildlaus (Kerria lacca), die „Lac“ als schützenden Belag ausschied. Dieser wurde gesammelt und als Farbmittel verwendet.[10] Der sehr stabile 4 : 2 : 2 Alizarin : Aluminium : Calcium-Komplex wird als Türkischrot, C.I. Pigment Rot 83, bezeichnet. Türkischrot war der einzige Metallkomplex, der bis zur Entwicklung der synthetischen Farbstoffe im größeren Umfang verwendet wurde.
Die Untersuchung des Alizarins und anderer Beizenfarbstoffe führte 1887 zur Aufstellung der „Beizenregel“ durch Carl Liebermann und Stanislaus von Kostanecki, nach der „nur jene Oxyanthrachinone beizenziehende Farbstoffe sind, die zwei o-ständige Hydroxyle enthalten“ und damit eine Strukturverwandtschaft zum Alizarin aufweisen.[45] Durch thermischen Abbau oder UV-Strahlung zerfällt Alizarin im Laufe der Zeit auf der Faser zu Benzoesäure, 2,4-Di-tert-Butylphenol, Phthalsäureanhydrid und Dimethylphthalat.[46]
Medizinische Aspekte
Die medizinische Verwendung von Krapp wurde von Pedanios Dioskurides in De Materia Medica (Über Arzneistoffe) beschrieben, einem frühen pharmakologischen Werk aus dem 1. Jahrhundert. Es wurde als Diuretikum und zur Behandlung von Gelbsucht, Ischias und Lähmungen genutzt.[40] In der klinischen Chemie und Histologie dient Alizarin als Anfärbemittel zum Beispiel zur Untersuchung von Calcium-Ablagerungen in Hirngewebe.[47] Die Untersuchung von Alizarin auf sein antigenotoxisches Potenzial gegenüber Mutagenen wie 4-Nitro-o-phenylendiamin und 2-Aminofluoren zeigten eine modulierende Aktivität gegen deren Genotoxizität.[48] Rubia-tinctorum-Extrakte weisen eine biologische Aktivität bei Nierensteinen auf. Die Wirkung ist möglicherweise durch Alizarin bedingt, das die Calcium- und Magnesiumionen der Nierensteine komplexieren und diese dadurch abbauen könnte.[44]
Kunst
_Vermeer_-_Christ_in_the_House_of_Martha_and_Mary_-_Google_Art_Project.jpg.webp)
Krapplack dient als Pigment, etwa für die Herstellung von lichtechten Tapeten, für Künstlerfarben und Druckfarben. Er war seit der Antike als rotes Pigment in der Malerei in Gebrauch, so etwa bei Johannes Vermeers Gemälde „Christus bei Maria und Martha“ (um 1654), bei dem die rote Bluse der Maria in Krapplack gemalt ist.[49]
Farbstoffsolarzellen
Moderne Farbstoff-Solarzellen basieren auf Metalloxidfilmen aus Titandioxid, die etwa durch adsorbiertes Alizarin zur Erhöhung der Lichtausbeute sensibilisiert werden. Der Elektronentransfer erfolgt dabei vom photochemisch angeregte Alizarin als Elektronendonator zum Leitungsband des Titandioxids als Elektronenakzeptor.[40] Der Transfer von lichtangeregten Elektronen in das Leitungsband des Metalloxids ist der Schlüsselschritt, der eine effiziente Umwandlung von Solarenergie ermöglicht.
Alizarinfarbstoffe
Die Alizarinfarbstoffe leiten sich vom Alizarin durch die Einführung weiterer Substituenten wie Hydroxy-, Nitro- oder Sulfogruppen am Anthrachinongerüst ab. Bekannte Vertreter sind unter anderem das Purpurin mit einem weiteren Hydroxysubstituenten an R4, das ebenfalls in der Wurzel des Färberkrapp vorkommt, sowie das Chinalizarin oder Alizarinbordeaux, mit zwei weiteren Hydroxygruppen an R5 und R8.[51] Die Alizarinfarbstoffe sind gute Beizenfarbstoffe, die auf mit Aluminium- oder Chrom-gebeizter Wolle gute Echtheitseigenschaften aufweisen.
| Name | Struktur (R1, R2 = OH; R6 = H) | R3 | R4 | R5 | R7 | R8 |
|---|---|---|---|---|---|---|
| Alizarin | 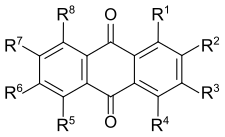 | –H | –H | –H | –H | –H |
| Alizarin R | –OH | –H | –H | –H | –H | |
| Alizarinbordeaux | –H | –H | –OH | –H | –OH | |
| Alizarincyanin R | –H | –OH | –OH | –H | –OH | |
| Purpurin | –H | –OH | –H | –H | –H | |
| Isopurpurin | –H | –H | –H | –OH | –H | |
| Alizarinorange | –NO2 | –H | –H | –H | –H | |
| Alizarinrot (Alizarin S) | –SO3H | –H | –H | –H | –H |
Alizarin S dient in der qualitativen Analytik im H2S-Trennungsgang als Nachweisreagenz auf Aluminium. Der Alizarinfarbstoff Alizarinkomplexon, 1,2-Dihydroxy-anthrachinon-3-methylen-iminodiessigsäure, wird zur photometrischen Bestimmung von Metallkationen und als Lanthankomplex zum Nachweis von Fluorid verwendet.[52]
Die Verwendung von Alizarin als Namensbestandteil von Farbmitteln ist nicht notwendigerweise ein Hinweis darauf, dass es sich dabei um einen Alizarinfarbstoff handelt. Alizaringelb R etwa ist ein Azofarbstoff, Alizarinschwarz ist ein Chinonfarbstoff.
Toxikologie
Die geringste bekannte toxische Dosis beträgt bei der Ratte bei oraler Aufnahme 6,72 Milligramm pro Kilogramm Körpergewicht.[53] Krapplack weist eine karzinogene Wirkung in der Niere und Leber der Ratte auf. Im Tierversuch wurde eine erhöhte karzinogene Wirkung des ebenfalls im natürlichen Krapplack vorkommenden Rubiadin festgestellt. Ein karzinogenes Potenzial ist beim Alizarin vorhanden, aber schwächer ausgeprägt als beim Rubiadin.[54]
Nachweis
Im Fluoreszenzspektrum zeigt Alizarin eine Absorptionsspitze bei 503 Nanometern und eine weniger ausgeprägte Schulter bei 307 Nanometern. Die Banden werden n→π* und π→π* Übergängen zugeschrieben.[55] Alizarin lässt sich mittels Umkehrphasenhochleistungsflüssigkeitschromatographie, gekoppelt mit Massenspektrometrie schon in geringen Mengen nachweisen.[56]
Weblinks
- Thomas Hapke: Vom Krapp zum Alizarin. TU Harburg
Einzelnachweise
- Eintrag zu CI 58000 in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- Eintrag zu Alizarin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Januar 2020.
- Carl L. Yaws: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals: Elsevier, 2015, ISBN 978-0-12-801146-1, S. 438.
- R. W. Sabnis: Handbook of Biological Dyes and Stains: John Wiley & Sons, 2010, ISBN 978-0-470-40753-0, S. 10.
- Eintrag zu Alizarin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Carl Graebe, Carl Liebermann: Ueber Anthracen und Alizarin.: Annalen der Pharmacie / Annalen der Chemie und Pharmacie, Jahrgang 1870, S. 707 (online bei ANNO).
- Alizarīn. In: Meyers Großes Konversations-Lexikon. 6. Auflage. Band 1, Bibliographisches Institut, Leipzig/Wien 1905, S. 332–333.
- Dictionary.com: alizarin bei Dictionary.com Unabridged (v 1.1). Random House, Inc.
- D. De Santis, M. Moresi: Production of alizarin extracts from Rubia tinctorum and assessment of their dyeing properties. In: Industrial Crops and Products. 26, 2007, S. 151–162, doi:10.1016/j.indcrop.2007.02.002.
- O. Stallmann: Use of metal complexes in organic dyes and pigments. In: Journal of Chemical Education. 37, 1960, S. 220–230, doi:10.1021/ed037p220.
- C. G. Giebel (Hrsg.): Zeitschrift für die Gesammten Naturwissenschaften. Dritte Folge, 1877, Band I. Verlag von Wiegandt, Hempel und Parey, Berlin, S. 302–307.
- Norbert Welsch, Claus Christian Liebmann: Farben: Natur, Technik, Kunst. Springer Verlag, Berlin, 2018, ISBN 978-3-662-56624-4, S. 146.
- Louis F. Fieser: The discovery of synthetic alizarin. In: Journal of Chemical Education. 7, 1930, S. 2609, doi:10.1021/ed007p2609.
- Jaime Wisniak: Pierre-Jean Robiquet. In: Educación Química. 24, 2013, S. 139–149, doi:10.1016/S0187-893X(13)72507-2.
- W. Karrer: Anthrachinone (incl. Anthrone u. Anthranole). In: Konstitution und Vorkommen der organischen Pflanzenstoffe (exclusive Alkaloide). Chemische Reihe, Vol 12., 1976, Birkhäuser, Basel, doi:10.1007/978-3-0348-5142-8_14.
- C. Graebe, C. Liebermann: Ueber Alizarin und Anthracen. In: Berichte der deutschen chemischen Gesellschaft. Band 1, Nr. 1, Januar 1868, S. 49, doi:10.1002/cber.18680010120.
- Gopalpur Nagendrappa: Johann Friedrich Wilhelm Adolf von Baeyer. In: Resonance. 19.6, 2014, S. 489–522, doi:10.1007/s12045-014-0055-5.
- J. Brönner, H. Gutzkow: CXXV. Verfahren zur Darstellung von Anthracen aus dem Pech von Steinkohlentheer, und zur Darstellung von Farbstoffen aus Anthracen. In: Polytechnisches Journal, 1871, Band 201, Nr. CXXV., S. 545–546. Bayerisches Patent vom 29. September 1869 und 26. Januar 1870.
- Werner Abelshauser (Hrsg.): Die BASF – Eine Unternehmensgeschichte. C. H. Beck Verlag, München 2002, ISBN 3-406-49526-5.
- Robert Chenciner: Madder Red: A History of Luxury and Trade. Routledge Curzon, London, New York, ISBN 0-203-40043-7, S. 341.
- S.P. Sadtler: A hand-book of industrial organic chemistry. J. B. Lippincott Comp., 1891, S. 418.
- Willy Herbst, Klaus Hunger: Industrielle Organische Pigmente: Herstellung, Eigenschaften, Anwendung. VCH, Weinheim, New York, Basel, Cambridge, Tokyo, 2009, ISBN 3-527-28744-2, S. 511–512.
- K. G. Gilbert (nee Stoker), D. T. Cooke: Dyes from plants: Past usage, present understanding and potential. In: Plant Growth Regulation, 34, 2001, S. 57–69, doi:10.1023/A:1013374618870.
- E. J. Tiedemann, Y. Yang: Fiber-Safe Extraction of Red Mordant Dyes from Hair Fibers. In: Journal of the American Institute for Conservation (JAIC), 34, Nr. 3, 1995, S. 195–206, doi:10.2307/3179540.
- Bernd Schaefer: Natural Products in the Chemical Industry. Springer, Heidelberg, New York, Dordrecht, London, ISBN 978-3-642-54460-6, S. 16; 36–44.
- Mark C. Whiting: Die Farbstoffe in frühen Orientteppichen. In: Chemie in unserer Zeit. 15, 1981, S. 179–189, doi:10.1002/ciuz.19810150603.
- Externe Identifikatoren von bzw. Datenbank-Links zu 2-Succinylbenzoesäure: CAS-Nummer: 27415-09-4, PubChem: 955, ChemSpider: 930, DrugBank: DB02251, Wikidata: Q27093288.
- Externe Identifikatoren von bzw. Datenbank-Links zu 1,4-Dihydroxy-2-naphthoesäure: CAS-Nummer: 31519-22-9, EG-Nummer: 250-674-7, ECHA-InfoCard: 100.046.052, PubChem: 671, ChemSpider: 651, Wikidata: Q27102818.
- Eckhard Leistner: Mode of incorporation of precursors into alizarin (1,2-dihydroxy-9,10-anthraquinone). In: Phytochemistry. Band 12, Nr. 2, Februar 1973, S. 337–345, doi:10.1016/0031-9422(73)80015-9.
- Eckhard Leistner: Biosynthesis of morindone and alizarin in intact plants and cell suspension cultures of Morinda citrifolia. In: Phytochemistry. Band 12, Nr. 7, Juli 1973, S. 1669–1674, doi:10.1016/0031-9422(73)80385-1.
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig, Berlin, Heidelberg, 1993, ISBN 3-335-00343-8, S. 383.
- Carl Graebe, Carl Liebermann: Das künstliche Alizarin. Vieweg und Sohn, Braunschweig, 1876, S. 8.
- C. Graebe, C. Liebermann: Ueber künstliches Alizarin. In: Berichte der deutschen chemischen Gesellschaft. 2, 1869, S. 332–334, doi:10.1002/cber.186900201141.
- Externe Identifikatoren von bzw. Datenbank-Links zu Anthrachinon-2-sulfonsäure: CAS-Nummer: 84-48-0, EG-Nummer: 201-532-8, ECHA-InfoCard: 100.001.393, PubChem: 8552, ChemSpider: 8234, Wikidata: Q27275022.
- H. Caro, C. Graebe, C. Liebermann: Ueber Fabrikation von künstlichem Alizarin. In: Berichte der deutschen chemischen Gesellschaft. 3, 1870, S. 359–360, doi:10.1002/cber.187000301122.
- Adolf Baeyer, Heinrich Caro: Synthese von Anthrachinonabkömmlingen aus Benzolderivaten und Phtalsäure. In: Berichte der deutschen chemischen Gesellschaft. Band 7, Nr. 2, Juli 1874, S. 968, doi:10.1002/cber.18740070206.
- C. Liebermann: Ueber ein neues Dioxyanthrachinon, das Hystazarin. In: Berichte der deutschen chemischen Gesellschaft. 21, 1888, S. 2501–2502, doi:10.1002/cber.18880210252.
- Munenari Tanaka: Eine Neue Synthese Von Alizarin. In: Bulletin of the Agricultural Chemical Society of Japan. 3, 2014, S. 17–20, doi:10.1080/03758397.1927.10856809.
- PubChem Datenbank 6293
- Michał K. Cyrański u. a.: On two alizarin polymorphs. In: CrystEngComm. 14, 2012, S. 3667–3676, doi:10.1039/c2ce06063a.
- W. H. Perkin: XXIII.—On acetyl- and nitro-derivatives of alizarin. In: J. Chem. Soc.. 30, 1876, S. 578–581, doi:10.1039/JS8763000578.
- Luciano Carta, Malgorzata Biczysko, Julien Bloino, Daniele Licari, Vincenzo Barone: Environmental and complexation effects on the structures and spectroscopic signatures of organic pigments relevant to cultural heritage: the case of alizarin and alizarin–Mg(ii)/Al(iii) complexes. In: Physical Chemistry Chemical Physics. 16, 2014, S. 2897–2911, , doi:10.1039/c3cp50499a.
- Christian-Heinrich Wunderlich, Günter Bergerhoff: Konstitution und Farbe von Alizarin- und Purpurin-Farblacken. In: Chemische Berichte. 127, 1994, S. 1185–1190, doi:10.1002/cber.19941270703.
- Holde Puchtler, Susan N. Meloan, Mary S. Terry: On the History and Mechanism of Alizarin and Alizarin Red S Stains for Calcium. In: Journal of Histochemistry & Cytochemistry. 17, 1969, S. 110–124, doi:10.1177/17.2.110.
- C. Liebermann, S. T. V. Kostanecki: Ueber die Färbeeigenschaften und die Synthesen der Oxyanthrachinone;. In: Justus Liebigs Annalen der Chemie. 240, 1887, S. 245–304, doi:10.1002/jlac.18872400302.
- Cheunsoon Ahn, S. Kay Obendorf: Dyes on Archaeological Textiles: Analyzing Alizarin and Its Degradation Products. In: Textile Research Journal. 74, 2016, S. 949–954, doi:10.1177/004051750407401102.
- J.-C. Lievens u. a.: Characterization of Striatal Lesions Produced by Glutamate Uptake Alteration: Cell Death, Reactive Gliosis, and Changes in GLT1 and GADD45 mRNAExpression. In: Glia, 29, 2000, S. 222–232, PMID 10642749.
- Prabhjit Kaur u. a.: Modulatory role of alizarin from Rubia cordifolia L. against genotoxicity of mutagens. In: Food and Chemical Toxicology. 48.1, 2010, doi:10.1016/j.fct.2009.10.019.
- Pigment: Crimson, Madder and Alizarin. (abgerufen am 15. Februar 2021).
- Ali A. Ensafi, A. Kazemzadeh: Optical pH Sensor Based on Chemical Modification of Polymer Film. In: Microchemical Journal, 63, 1999, S. 381–388.
- Otto Lueger: Lexikon der gesamten Technik und ihrer Hilfswissenschaften, Bd. 1 Stuttgart, Leipzig, 1904, S. 140–142.
- M. Krizan, J. Nozaki: Anwendung des Alizarins und seiner Derivate zur Molybdänbestimmung. In: Mikrochimica Acta. 64, 1975, S. 435–441, doi:10.1007/BF01219210.
- Sicherheitsdatenblatt von Alizarin.
- Kaoru Inoue u. a.: Carcinogenic potential of alizarin and rubiadin, components of madder color, in a rat medium-term multi-organ bioassay. In: Cancer Science. 100, 2009, S. 2261–2267, doi:10.1111/j.1349-7006.2009.01342.x.
- Dewan S. Rahman, Hirak Chatterjee, Sujit Kumar Ghosh: Excess Surface Energy at the Tips of Gold Nanospikes: From Experiment to Modeling. In: The Journal of Physical Chemistry C. 2015, S. 150615143906005, doi:10.1021/acs.jpcc.5b03944.
- Irina Petroviciu, Florin Albu, Andrei Medvedovici: LC/MS and LC/MS/MS based protocol for identification of dyes in historic textiles. In: Microchemical Journal. 95, 2010, S. 247–254, doi:10.1016/j.microc.2009.12.009.



.svg.png.webp)
