Corilagin
Corilagin ist ein Naturstoff und gehört zu den Tanninen, einer Gruppe von Gerbstoffen, deren bedeutendster Vertreter es ist. Es ist ein typischer Vertreter der Ellagengerbstoffe.[3]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
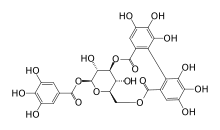 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Corilagin | ||||||||||||
| Summenformel | C27H22O18 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 634,45 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Corilagin wurde erstmals 1951 aus Dividivi-Extrakten und aus Caesalpinia coriaria isoliert.[4][5] In der Traditionellen Chinesischen Medizin wurden Extrakte der Pflanze Phyllanthus urinaria, welche Corilagin enthalten, aufgrund ihrer antiviralen und antibakteriellen Wirkung als Heilmittel verabreicht.[6]
Gewinnung und Darstellung

Corilagin kann aus den Wurzeln von Euphorbia fisheriana (ein Wolfsmilchgewächs),[7] dem Granatapfel (Punica granatum)[8] oder getrockneten Früchten von Terminalia chebula (Chebulische Myrobalane) gewonnen werden.[9]
Dabei werden die gesammelten Pflanzenteile zunächst zerkleinert und in Wasser gelegt. Im Wasser lösen sich die hydrophilen Bestandteile. Danach wird die wässrige Lösung mit einem Gemisch aus Diethylether und Ethanol (im Verhältnis 4 zu 1) behandelt, um das Corilagin herauszulösen.
Eigenschaften
Corilagin bildet lange, farblose, wenig charakteristische Nadeln, die sich (lufttrocken) bei etwas über 200 °C zersetzen. Es löst sich leicht in Aceton, Methanol und Ethanol, schwer in Eisessig und Wasser, sehr schwer in Essigester und ist praktisch unlöslich in Benzol und Ether. Aus Wasser kristallisiert es als Trihydrat und ist als Anhydrat hygroskopisch.[10]
Es gehört zu den Gruppen der Polyphenole und der Ellagitannine. Corilagin kann durch verdünnte Schwefelsäure und mehrtägiges Erhitzen (100 °C) hydrolysiert werden, wobei sich zuerst Gallussäure abspaltet und es sich dann zu Traubenzucker, Ellagsäure und Gallussäure zersetzt.[11]
Biologische Bedeutung
Corilagin inhibiert die Adrenalin-induzierte Lipolyse in aus Ratten isolierten Fettzellen.[12]
Einzelnachweise
- Datenblatt Corilagin, analytical standard bei Sigma-Aldrich, abgerufen am 29. Mai 2016 (PDF).
- Shmuel Yannai: Dictionary of Food Compounds with CD-ROM, Second Edition. CRC Press, 2012, ISBN 978-1-4200-8352-1, S. 294 (eingeschränkte Vorschau in der Google-Buchsuche).
- Der Stoffwechsel Sekundärer Pflanzenstoffe / The Metabolism of Secondary Plant Products. Springer Science & Business Media, 2013, ISBN 978-3-662-26784-4, S. 365 (eingeschränkte Vorschau in der Google-Buchsuche).
- O. Th. Schmidt, R. Lademann (1951): Liebigs Ann. Chem., 571, S. 232–237.
- O. Th. Schmidt, D. M. Schmidt (1952): Liebigs Ann. Chem., 578, 25–30.
- P. Grunwald (1998): Nachr. Chem. Tech. Lab., 46, S. 853–857.
- S.-H. Lee, T. Tanaka, G.-I. Nonaka, I. Nishioka, B. Zhang (1991): Phytochemistry, 30, S. 1251–1253.
- M. A. Nawwar, S. A. M. Hussein, I. Merfort: (1994): Phytochemistry, 36, S. 793–798.
- O. Th Schmidt, J. Schulz, H. Fiesser (1967): Liebigs Ann. Chem., 706, S. 187–197.
- K. Paech, M. V. Tracey: Moderne Methoden der Pflanzenanalyse / Modern Methods of Plant Analysis. Springer Science & Business Media, 2012, ISBN 978-3-642-64958-5, S. 546 (eingeschränkte Vorschau in der Google-Buchsuche).
- Die Bestandteile der Lebensmittel. Springer-Verlag, 2013, ISBN 978-3-642-46011-1, S. 561 (eingeschränkte Vorschau in der Google-Buchsuche).
- Y. Kimura, H. Okuda, T. Okuda, T. Yoshida, T. Hatano, S. Arichi (1983): Chem Pharm Bull., 31, S. 2497–2500.