Thiocyanate
Als Thiocyanate (veraltet auch Rhodanide) werden die Salze und die Ester der unbeständigen Thiocyansäure (Rhodanwasserstoffsäure) HSCN bezeichnet. Der Name „Rhodanid“ leitet sich von griechisch rhodos für „rot“ ab, da Eisen(III)-thiocyanat eine tiefrote Farbe besitzt. Die Salze lassen sich am einfachsten durch Schmelzen der entsprechenden Cyanide mit Schwefel herstellen.[1]
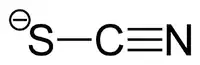
Thiocyanat in ionischer Form (SCNˉ) ist ein physiologischer Bestandteil extrazellulärer Körperflüssigkeiten.[2] Die Ausscheidung über die Nieren erfolgt langsam mit Halbwertszeiten von etwa 3 Tagen.[3] Im Zeitraum zwischen 1930 und 1950 war Thiocyanat in Form seiner Natrium- oder Kaliumsalze der meistverordnete Wirkstoff zur Behandlung der Bluthochdruckkrankheit.[4][5]
Chemie
Das Thiocyanation (SCN−) kann als Ligand in Komplexen sowohl über das Stickstoff- als auch über das Schwefelatom an das Zentralatom koordinieren. In seinem chemischen Verhalten ähnelt es den Halogenen und wird daher seit 1925 zur Gruppe der Pseudohalogene gezählt. Maßgeblich für die biologische Aktivität von Thiocyanat-Ionen ist die Vielfalt der Anordnungs- und Verteilungsmöglichkeiten seiner 16 Elektronen, die neben ionischen Wechselwirkungen koordinative Bindungen über N-S-Ligatoratome in Form von ein- bis fünfzähnigen Verknüpfungen sowie eine kovalente oder koordinative Fixierung zu Rezeptoren und Bindungspartnern eingehen können.[6]
Kaliumthiocyanat ist das bekannteste Salz und wird unter anderem für den Nachweis von Fe3+-Ionen verwendet, wobei das tiefrot gefärbte Eisen(III)-thiocyanat (Fe(SCN)3) entsteht.
Die Ester R−S−C≡N (R = organischer Rest, wie Alkylrest, Arylrest etc.) der Thiocyansäure werden Thiocyansäureester genannt und sind Konstitutions-Isomere der Isothiocyansäureester R-N=C=S. Sie riechen knoblauchartig und sind nur wenig beständig.[1]
Thiocyansäureester kann man aus Bunte-Salzen und Natriumcyanid in einer Stufe synthetisieren.[7]

Vorkommen, Geschichte und Biochemie
Thiocyanat ist in der belebten Natur ubiquitär verbreitet mit der Besonderheit, dass es schon in der präbiotisch-chemischen Evolution vorhanden war und selbst im interstellaren Raum zahlreiche SCN-Atomgruppierungen nachgewiesen wurden.[8] Ursache hierfür ist, dass Ammoniumthiocyanat aus Schwefelkohlenstoff und Ammoniak unter Druck und erhöhter Temperatur (110 °C) entsteht. Für die Bedeutung von Thiocyanat im Zellstoffwechsel (s. u.) dürfte die exogene und endogene Präsenz während der Evolution des Lebens Voraussetzung gewesen sein.[9] 1798 entdeckte der Chemiker Buchholz die Reaktion von Schwefel mit Cyaniden zu Thiocyanat. Porett (1809) bezeichnete die beim Kochen von Schwefelkalium und Berliner Blau entstehende Verbindung als Schwefelblausäure. 1814 beschrieb Gottfried Reinhold Treviranus die Rotfärbung des Speichels bei Zugabe einer gesättigten Eisen(III)-salzlösung in Salpeter- oder Schwefelsäure. Tiedemann und Gmelin (1826) führten diese Reaktion auf KSCN zurück; damit war das natürliche Vorkommen von SCN- im Speichel entdeckt. 1829 wurde von Friedrich Wöhler erstmals freie Rhodanwasserstoffsäure synthetisiert. Die Untersuchungen von Hofmeister 1888 waren der Beginn der zielgerichteten Untersuchung des Einflusses von SCN− und anderen im Organismus vorkommenden Anionen auf physiologische Vorgänge.[10] Vor allem die menschlichen Leberzellen erzeugen Thiocyanat durch Entgiftung von im Zellstoffwechsel entstehenden Cyaniden durch das in den Mitochondrien lokalisierte und von Lang entdeckte Enzym Rhodanase (Thiosulfat: Cyanid-Sulfurtransferase).[11] Sowohl in den Mitochondrien als auch im Cytoplasma von Leber, Nieren, Gehirn und Myokard existiert noch ein weiteres für den Cyanidabbau verantwortliches Enzym, die 3-Mercaptopyruvat-Cyanid-Sulfurtransferase.[12] Aus einigen Nahrungsmitteln, wie Kohl, können Thiocyanate aus den darin enthaltenen Senfölglykosiden, wie etwa Glucobrassicin, enzymatisch freigesetzt werden, andere Nahrungsmittel enthalten das Thiocyanat direkt. Vor allem mit lacto-vegetabiler Kost wird reichlich Thiocyanat aufgenommen.[13]
Thiocyanat hemmt in höheren Konzentrationen die Aufnahme von Jodid in die Schilddrüse und damit die Bildung der Hormone Thyroxin und Trijodthyronin.[14][15] Bei alimentärer Aufnahme in physiologischen Bereichen 4–8 mg SCN−/d dürfte der thyreostatische Effekt aber gering sein.[16] Mit dem Rauchen zugeführtes Cyanid wird ebenfalls zu Thiocyanat entgiftet, so dass über diesen Weg früher der Tabakkonsum nachgewiesen wurde.[17]
Die Thiocyanatbildung erfolgt im sog. Thiocyanat-Cyanid-Zyklus, in dem ein zum Thiocyanat verschobenes Gleichgewicht zu Cyanid besteht. Bei Abfall des Thiocyanat-Serumspiegels kommt es zu einer Aktivierung; an der Bildung sind die beiden Transferasen und die Thiosulfatreductase beteiligt.[18] Andererseits reagieren Thiocyanat und Wasserstoffperoxid mittels der Enzyme Lactoperoxidase, Myeloperoxidase und eosinophiler Peroxidase zu Hypothiocyanit und höheren Oxidationsprodukten.[19]
Mutmaßliche biologische Wirkungen
Lange Zeit galt Thiocyanat nur als Entgiftungsprodukt von Cyanid ohne eigene physiologische bzw. biochemische Bedeutung. Auf Grund der ubiquitären Präsenz von Thiocyanat in allen Zellen und Körperflüssigkeiten von Mensch und Säugetier, der beobachteten Konzentrationsänderungen im menschlichen Organismus z. B. bei Immunisierung, Infektion, Stress, toxischer Belastung, UV-Strahlung und bestimmten Erkrankungen[8] und dem erstmals 1968 geführten Nachweis der Stimulierung der humoralen Immunantwort[20] setzte eine intensive Erforschung weiterer Wirkungen dieses bioaktiven Anions ein. In deren Ergebnis konnten folgende Wirkungen bei physiologischen Dosierungen im Rahmen der physiologischen Regelbreite gesichert werden: Stimulierung von Wundheilung, Phagozytose, Spermiogenese, Haarbildung und Interferonproduktion sowie der Chemofusion bei Protoplasten.[8] Die Stimulation ist besonders ausgeprägt bei SCN−-Mangel oder bei erhöhtem Bedarf. Außerdem wirkt Thiocyanat antiphlogistisch und protektiv bei infektiöser, allergischer, toxischer, irritativer und mutagener Belastung.[8] Die antiinfektiöse Schutzwirkung beruht sowohl auf der Förderung der Kolonisationsresistenz als auch indirekt durch Bildung von Hypothiocyanit. Bei der Pflanze werden die vegetative Entwicklung, der Ertrag und die Resistenz gegen Mikroorganismen gefördert und eine Schutzwirkung bei toxischer Belastung erreicht.[8] Die durch Oxidation entstehenden Hypothiocyanite sind antimikrobiell hochwirksam und essenziell für die mikrobielle Abwehr in der Mundhöhle,[19] den Atemwegen, der Tränenflüssigkeit, der Milch, im Vaginalsekret und weiteren Kompartimenten.[10]
Durch Thiocyanat wird die Konformation sog. konformationslabiler Proteine in Abhängigkeit von der Art des Liganden der Eisenporphyrine geändert. Auf einer Konformationsänderung beruht offenbar auch die in physiologischen Thiocyanatkonzentrationen aktivitätssteigernde Wirkung auf eine Reihe Arzneimittel metabolisierender und weiterer Enzyme, z. B. Kollagenase, Lysozym, Na+-, K+-, Mg2+- und anionensensitive ATPase (Myelo- und Lactoperoxidase), Phosphodiesterase; über Letztere kann Thiocyanat über den „Second Messenger“ cAMP Wachstums- und Teilungsprozesse beeinflussen. Weitere auf molekularer Ebene Wirkungen sind die Verschiebung thermodynamischer Gleichgewichte, der Schutz von SH-Gruppen, die Lockerung von H-Brücken-Bindungen mit Entropiezunahme, die Beeinflussung der Hydratation und Affinität von Biomakromolekülen (z. B. bei Antikörpern und Hormonrezeptoren), von Kationen- und Anionentransportprozessen, der Anstieg des Transmembranpotenzials mit damit verbundener Stabilisierung der Zellmembran und der Modulation von Transportvorgängen, die Hemmung der Bildung freier Radikale, die Stabilisierung der DNA und die Hemmung des oxidativen Metabolismus. Über Wechselwirkungen mit den Wasserstoffperoxid-Peroxidase-Systemen ist Thiocyanat in physiologische Kreisprozesse mit konzentrationsabhängig unterschiedlichen Auswirkungen eingebunden, z. B. Beeinflussung von Glykolyse und Glucosetransport, Immunregulation, zytolytischer Lymphozytenaktivität mit Hemmung von Entzündungsreaktionen und Verminderung der DR-Antigene auf der Zelloberfläche. In vitro haben Thiocyanat-Ionen signifikante Effekte auf Glukokortikoidrezeptoren. Offenbar beruht die biologische Aktivität von Thiocyanat-Ionen nicht auf einem einheitlichen Wirkungsmechanismus, sondern ist als Summe verschiedener Teileffekte aufzufassen.[10]
Pharmakokinetik
Thiocyanat ist ein physiologischer Bestandteil im Blutserum. Es wird aus verschiedenen Vorprodukten mit der Nahrung aufgenommen. Daneben entsteht es im Körper bei der enzymatischen Entgiftung von Cyanid.[21][22] Thiocyanat verteilt sich im Körper ähnlich wie Chlorid und wird wie dieses in den Magen sezerniert. Es dringt kaum in die Zellen ein und wurde deshalb zur Ermittlung des extrazellulären Flüssigkeitsvolumens verwendet.[23][24][25] Zwecks Messung der Konzentration im Blutserum wird es zunächst mit elementarem Chlor (aus Chloramin T) in Chlorcyan umgewandelt, das einem Pyridin-Barbitursäure-Mischreagenz unter Bildung eines Polymethinfarbstoffes reagiert. Dessen Extinktion wird photometrisch bei 578 nm gemessen.[26][27] Die Konzentration wird meist in Mikromol Thiocyanat pro Liter (µmol/L; 1 µmol = 58 µg SCNˉ) angegeben. Die physiologischen Spiegel bei Gesunden betragen 50–250 µmol/L.
In Humanversuchen wurde Thiocyanat nach oraler Applikation von 540–1800 mg SCNˉ als Einzeldosis nahezu vollständig resorbiert. Das Verteilungsvolumen errechnete sich bei sieben gesunden Probanden auf etwa 0,25 L/kg Körpergewicht und bei acht niereninsuffizienten Patienten auf 0,36 L/kg. Die Ausscheidung erfolgte bei den Gesunden fast vollständig mit dem Urin. Die Eliminationshalbwertzeit im Blutserum betrug bei den Gesunden im Mittel 2,7 Tage, bei den Niereninsuffizienten im Mittel neun Tage. Die Eliminationskonstante verkürzt sich dabei proportional mit der Kreatinin-Clearance und beträgt einer renalen Clearance von 0 ml/min nur noch 15 % des Wertes bei einer Clearance von 120 ml/min. Bei repetierter Applikation kumuliert Thiocyanat deshalb im Körper. Das gilt in besonderem Maße für Patienten mit eingeschränkter Nierenfunktion. Bei therapeutischer Anwendung von Thiocyanat als Antihypertensivum, aber auch im Rahmen der Infusionstherapie mit Nitroprussid (siehe Wikipedia: Nitroprussid), kam es in diesem Zusammenhang zu folgenschweren Vergiftungen.[28][15][29][3]
Thiocyanat als Antihypertensivum
Thiocyanat in Form seiner Natrium- und Kaliumsalze war seit etwa 1930 für 2 Jahrzehnte das meist verordnete Arzneimittel zur Behandlung von Patienten mit arterieller Hypertonie.[4][30][31][32] Erst um das Jahr 1950 wurde es in dieser Indikation von Rauwolfia-Extrakten beziehungsweise Reserpin abgelöst. Kaliumthiocyanat wurde langfristig in Dosierungen bis zu 1 g täglich eingenommen. Nach heutigen Maßstäben war die blutdrucksenkende Wirkung dennoch nur schwach ausgeprägt.[5] Die therapeutische Breite war sehr gering.[33]
Toxizität und Risiken
Die antihypertensive Therapie mit Thiocyanat hat ein umfangreiches Erkenntnismaterial zu dessen Toxizität, seinen Nebenwirkungen und Risiken hinterlassen. Als „therapeutischer Bereich“ galten Konzentrationen im Blutserum von 1400–2000 µmol/L.[33][14][32][5] Intoxikationen wurden in Einzelfällen aber auch schon niedrigeren Serumspiegeln beobachtet.[32][34] Bei „therapeutischen Blutspiegeln“ waren Schwindel, Schwäche, Nervosität, Kopfschmerzen, Schläfrigkeit, Exantheme, Appetitlosigkeit und Übelkeit verbreitete Begleiterscheinungen.[31][33][14][32][34][5]
Schwere Nebenwirkungen, wie Muskel- und Thoraxschmerzen, Angina pectoris, Synkopen, hämorrhagische Gastritis, Erbrechen, Durchfälle und schließlich Parästhesien, Desorientiertheit Hör- und Schlafstörungen Aphasie, Paralyse der Extremitäten, halluzinatorische Psychose und Koma wurden bei Serumspiegeln über 2500 µmol/L beschrieben.[33][14][32][35][5][34][36] Nach mehrwöchigen Behandlungen wurden Hypothyreosen beobachtet.[14] Tödliche Vergiftungen wurden bei Serumspiegeln über 3500 µmol/L beschrieben.[4][37][35][38][39][34][28] Aus 43 bekanntgewordenen Fälle so genannter „Thiocyanat-Psychosen“ errechnete sich eine Mortalitätsrate von 23 %.[28] Die Hämodialyse wurde als Methode der Wahl zur Behandlung von Thiocyanat-Intoxikationen beschrieben.[40][36][15]
Verwendung als Kosmetikum
Als Natriumthiocyanat findet Thiocyanat kosmetische Anwendung als Haarwuchsmittel sowie zur Hautpflege bei Neurodermitis.[41][42][43][44]
Weblinks
Einzelnachweise
- Beyer-Walter: Lehrbuch der Organischen Chemie. 23. Auflage. S. Hirzel Verlag, 1998.
- Eugene Grimley: A Review of: “Chemistry and Biochemistry of Thiocyanic Acid and Its Derivatives, Edited by A. A. Neman, Academic Press, New York, 1975, xiv + 351 pp, $31.00 (hardback)”. In: Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. Band 8, Nr. 4, Januar 1978, ISSN 0094-5714, S. 415–416, doi:10.1080/00945717808057430.
- V. Schulz: Clinical Pharmacokinetics of Nitroprusside, Cyanide, Thiosulphate and Thiocyanate. In: Clinical Pharmacokinetics. Band 9, Nr. 3, 1984, ISSN 0312-5963, S. 239–251, doi:10.2165/00003088-198409030-00005.
- James Clarke Healy: Therapeutics and Toxicology of the Sulphocyanates. In: New England Journal of Medicine. Band 205, Nr. 12, 17. September 1931, ISSN 0028-4793, S. 581–583, doi:10.1056/nejm193109172051206.
- Arthur Ruskin, W.Frank McKinley: Comparative study of potassium thiocyanate and other drugs in the treatment of essential hypertension. In: American Heart Journal. Band 34, Nr. 5, November 1947, ISSN 0002-8703, S. 691–701, doi:10.1016/0002-8703(47)90347-5.
- H. Böhland, V. M. Samoilenko: Thiocyanate Compounds. In: A. M. Golub, H. Köhler, V. V. Skopenkoe (Hrsg.): Chemistry of Pseudohalides. Elsevier, Amsterdam 1986, S. 239–363.
- Siegfried Hauptmann: Organische Chemie. 2., durchgesehene Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 470.
- W. Weuffen, A. Kramer, H. Below, H. Böhland, W. D. Jülich, B. Thürkow, U. Burth: Das Thiocyanation als physiologisch bedeutsamer Wirkstoff in der belebten Natur. In: Die Pharmazie. 45(1), 1990, S. 16–29.
- W. Weuffen, A. Kramer, H. Ambrosius, V. Adrian, H. Below, W. D. Jülich, S. Koch, B. Thürkow, F. Verbeek: Zur Bedeutung des endogenen Wirkstoffs und Umweltfaktors Thiopcyanat für die unspezifische und spezifische Resistenz aus hygienischer Sicht. In: Zentralblatt für Hygiene und Umweltmedizin. 189, 1990, S. 473–510.
- A. Kramer, H. Böhland, H. Below: Anorganische Thiocyanate. In: A. Kramer, O. Assadian (Hrsg.): Wallhäusers Praxis der Sterilisation, Desinfektion, Antiseptik und Konservierung. Thieme, Stuttgart 2008, S. 891–894.
- K. Lang: Die Rhodanbildung im Tierkörper. In: Biochem Z. 259, 1933, S. 243–256.
- N. Nagahara, T. Ito, M. Minami: Mercaptopyruvate sulfurtransferase as a defense against cyanide toxication: molecular properties and mode of detoxification. In: Histol Histopathol. 14(4), 1999, S. 1277–1286.
- B. Thürkow, W. Weuffen, A. Kramer, H. Below, D. Johnson: Zur Bedeutung von Thiocyanat für die gesunde Ernährung des Menschen. In: Dt Lebensmittel-Rundschau. 88 (10), 1992, S. 307–313.
- M. Herbert Barker, Howard A. Lindberg, Maurice H. Wald: Further Experiences With Thiocyanates. In: Journal of the American Medical Association. Band 117, Nr. 19, 8. November 1941, ISSN 0002-9955, S. 1591, doi:10.1001/jama.1941.02820450015004.
- V. Schulz, W. Döhring, P. Rathsack: Thiozyanat-Vergiftung bei der antihypertensiven Therapie mit Natriumnitroprussid. In: Klinische Wochenschrift. Band 56, Nr. 7, April 1978, ISSN 0023-2173, S. 355–361, doi:10.1007/bf01477396.
- A. Kramer, W. Meng, D. Reinwein, W. Weuffen, H. Below, U. Ermisch, W.-D. Jülich, S. Koch, R. Kellner, S. Meng, O. Schibille, A. Straßenberg, K. Bauch, W. Straube, F. E. Ulrich, M. Ventz: Experimentelle und epidemiologische Untersuchungen zu Wechselbeziehungen von Thiocyanat und Schilddrüsenfunktion. In: Z ges Hyg. 36, 1990, S. 383–387.
- O. P. Foss, P. G. Lund-Larsen: Serum thiocyanate and smoking: interpretation of serum thiocyanate levels observed in a large health study. In: Scand J Clin Lab Invest. 46(3), 1986, S. 245–251.
- J. L. Wood: Biochemistry. In: A. A. Newman (Hrsg.): Chemistry and Biochemistry of Thiocyanic Acid and Its Derivatives. Academic Press, London 1975, S. 156–221.
- R. Ihalin, V. Loimaranta, J. Tenovuo: Origin, structure, and biological activities of peroxidases in human saliva. In: Arch Biochem Biophys. 445(2), 2006, S. 261–268.
- W. Weuffen, L. Behounkova, H. Maruschka: Untersuchungen zur Beeinflussbarkeit der Pferdeserumanaphylaxie des Meerschweinchens durch verschiedene Pharmaka. 1. In: Mitt. Acta biol med germ. 21, 1968, S. 127–130.
- K. Lang: Die Rhodanbildung im Tierkörper. In: Biochem Z. Band 259, 1933, S. 243–256.
- Williamina A. Himwich, Jack P. Saunders: ENZYMATIC CONVERSION OF CYANIDE TO THIOCYANATE. In: American Journal of Physiology-Legacy Content. Band 153, Nr. 2, 1. Mai 1948, ISSN 0002-9513, S. 348–354, doi:10.1152/ajplegacy.1948.153.2.348.
- Lathan A. Crandall, Milford X. Anderson: Estimation of the state of hydration of the body by the amount of water available for the solution of sodium thiocyanate. In: American Journal of Digestive Diseases and Nutrition. Band 1, Nr. 2, April 1934, ISSN 0092-5640, S. 126–131, doi:10.1007/bf02998796.
- Magnus I. Gregersen, John D. Stewart: Simultaneous Determination of the Plasma Volume with T-1824, and the "Available Fluid" Volume with Sodium Thiocyanate. In: American Journal of Physiology-Legacy Content. Band 125, Nr. 1, 31. Dezember 1938, ISSN 0002-9513, S. 142–152, doi:10.1152/ajplegacy.1938.125.1.142.
- Steward JD, Rourke GM: Simultaneous measurement of the plasma volume with thiocyanate and body fluid analysis in 33 normal individuals. In: J Lab Clin Med. Band 26, 1940, S. 1383–1387.
- E. Asmus, H. Garschagen: Über die Verwendung der Barbitursäure für die photometrische Bestimmung von Cyanid und Rhodanid. In: Fresenius' Zeitschrift für analytische Chemie. Band 138, Nr. 1, Januar 1953, ISSN 0016-1152, S. 414–422, doi:10.1007/bf00461093.
- R. B Bruce, J. W. Howard, R. F. Hanzal: Determination of Cyanide, Thiocyanate, and Alpha-Hydroxynitriles in Plasma or Serum. In: Analytical Chemistry. Band 27, Nr. 8, 1. August 1955, ISSN 0003-2700, S. 1346–1347, doi:10.1021/ac60104a044.
- Domzalski CA, Kolb LC, Hines EA: Delirious reactions secondary to thiocyanate therapy of hypertension. In: Proc Mayo Clin. Band 28, 1953, S. 272–280.
- V. Schulz, R. Bonn, J. Kindler: Kinetics of elimination of thiocyanate in 7 healthy subjects and in 8 subjects with renal failure. In: Klinische Wochenschrift. Band 57, Nr. 5, März 1979, ISSN 0023-2173, S. 243–247, doi:10.1007/bf01477493.
- William Goldring: Thiocyanate Therapy In Hypertension. In: Archives of Internal Medicine. Band 49, Nr. 2, 1. Februar 1932, ISSN 0730-188X, S. 321, doi:10.1001/archinte.1932.00150090151015.
- M. Herbert Barker: The Blood Cyanates In The Treatment Of Hypertension. In: Journal of the American Medical Association. Band 106, Nr. 10, 7. März 1936, ISSN 0002-9955, S. 762–767, doi:10.1001/jama.1936.02770100010004.
- L. F. Blaney, A. J. Geiger, R. G. Ernst: Potassium thiocyanate in the treatment of hypertension. In: Yale J. Biol. Med. Band 13, 1941, S. 493–508.
- Maurice H. Wald, Howard A. Lindberg, M. Herbert Barker: The Toxic Manifestations Of The Thiocyanates. In: Journal of the American Medical Association. Band 112, Nr. 12, 25. März 1939, ISSN 0002-9955, S. 1120–1124, doi:10.1001/jama.1939.02800120006002.
- Donald L. Kessler: Hazards Of Thiocyanate Therapy In Hypertension. In: Journal of the American Medical Association. Band 138, Nr. 8, 23. Oktober 1948, ISSN 0002-9955, S. 549–551, doi:10.1001/jama.1948.02900080007002.
- William O. Russell, William C. Stahl: Fatal Poisoning From Potassium Thiocyanate Treatment Of Hypertension. In: Journal of the American Medical Association. Band 119, Nr. 15, 8. August 1942, ISSN 0002-9955, S. 1177–1181, doi:10.1001/jama.1942.02830320023006.
- James Christensen: Thiocyanate Psychosis Treated by Extracorporeal Hemodialysis. In: JAMA. Band 181, Nr. 4, 28. Juli 1962, ISSN 0098-7484, S. 340, doi:10.1001/jama.1962.03050300060020b.
- Curtis F. Garvin: The Fatal Toxic Manifestations Of The Thiocyanates. In: Journal of the American Medical Association. Band 112, Nr. 12, 25. März 1939, ISSN 0002-9955, S. 1125, doi:10.1001/jama.1939.02800120011003.
- James Solomon, Milton Greenblatt, Gaylord Palmer Coon: Toxic Psychosis and Death Associated with Potassium Thiocyanate Therapy. In: New England Journal of Medicine. Band 229, Nr. 6, 5. August 1943, ISSN 0028-4793, S. 241–243, doi:10.1056/nejm194308052290603.
- V. Antonio del Solar: Fatal Poisoning From Potassium Thiocyanate Used In Treatment Of Hypertension. In: Archives of Internal Medicine. Band 75, Nr. 4, 1. April 1945, ISSN 0730-188X, S. 241, doi:10.1001/archinte.1945.00210280029004.
- Lamont E. Danzig: Dynamics of Thiocyanate Dialyses. In: New England Journal of Medicine. Band 252, Nr. 2, 13. Januar 1955, ISSN 0028-4793, S. 49–57, doi:10.1056/nejm195501132520203.
- Wundermittel gegen Haarausfall? Das bewirkt der Stoff Thiocyanat. Focus Online, 9. Februar 2017, abgerufen am 29. März 2017.
- Anwendung von Thiocyanat. Thiocyn GmbH, abgerufen am 29. März 2017.
- Patent EP0336236: Mittel und Verfahren zur qualitativen und quantitativen Förderung des Haarwuchses bei Mensch und Nutztier. Veröffentlicht am 11. Oktober 1989, Erfinder: Theodor Hiepe, Stephan Koch, Axel Kramer, Hans Meffert, Siegfried Minnich, Bodo Thürkow, Marietta Völzke, Norbert Völzke, Wolfgang Weuffen, Hans Winetzka.
- Patent DE4100975: Kosmetische oder pharmazeutische Zubereitungen zur Verbesserung der Haarqualität und Förderung des Haarwachstums. Veröffentlicht am 16. Juli 1992, Erfinder: Stefan Koch, Axel Kramer, Hans Meffert, Wolfgang Weuffen.