Zirconocen
Zirconocen ist eine hypothetische Verbindung mit 14 Außenelektronen, welche bisher nicht direkt beobachtet oder isoliert werden konnte. Es handelt sich um ein Metallocen, das heißt eine metallorganische Verbindung mit aromatischen Ringsystemen, in dessen Zentrum sich ein Zirconiumatom befindet. Eine in der Forschung aktuell entscheidende Frage ist, welche Liganden verwendet werden können, um das Zirconocenfragment Cp2ZrII zu stabilisieren und für weitere Reaktionen in der organischen Synthese verfügbar zu machen.[2]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
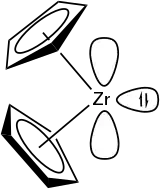 | ||||||||||
| Allgemeines | ||||||||||
| Name | Zirconocen | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C10H10Zr | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 221,40 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Struktur
Im Gegensatz zu der Sandwichverbindung Ferrocen mit gegenüberliegenden Pentadienylringen liegen Zirconocen und andere Metallocene der Gruppe 4 als gewinkelte Metallocenverbindung vor. Eine Überführung in Ferrocenanaloga ist für diese Metallocene problematisch. Stattdessen kann mithilfe von sogenannten Zirconocengeneratoren ein Cp2ZrII-Fragment generiert werden (s. u.). Ohne diese Liganden bildet sich ein zweikerniger Zirconiumkomplex, ein Fulvalenkomplex, aus.[3]
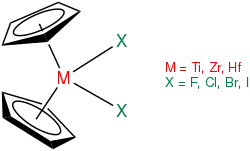
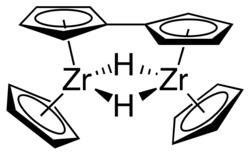
Geschichte
Die ersten Beispiele von Organozirconiumverbindungen wurden im Jahr 1954 von Wilkinson und Birmingham beschrieben. Dabei handelte es sich um Zirconocendihalogenide, Cp2ZrX2, mit X=Cl oder Br.[3] Eine systematische, umfangreiche Erforschung der Chemie von Zirconocen-Verbindungen erfolgte in den 1980er Jahren unter anderem durch Negishi, Takahashi und Buchwald. In den 1990er Jahren gelang Rosenthal die Synthese eines Zirconocen-bis(trimethylsilyl)-Komplexes, welcher ein breites Spektrum an Reaktionsmöglichkeiten bietet.[2] Seitdem ist dieser Forschungsbereich rapide gewachsen, sodass Zirconium zu einem der am meisten genutzten Übergangsmetalle bei der organischen Synthese geworden ist.[4]
Gewinnung und Darstellung
Die Cp2ZrII-Verbindung ist isoliert aufgrund ihrer Instabilität mit 14 Außenelektronen nicht existent, kann aber auf verschiedene Wege in situ erzeugt werden. Dabei lassen sich Liganden verwenden, welche zur Stabilisierung des Zirconocenfragmentes dienen. Ein möglicher Weg liegt in der Verwendung von π-Acceptorliganden wie Kohlenstoffmonoxid. Darüber hinaus kann eine Umsetzung mit Trimethylphosphin erfolgen.[3]
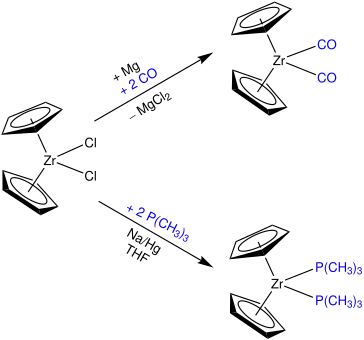
Alternativ liefert Zirconocendichlorid in Tetrahydrofuran mit zwei Equivalenten n-BuLi bei −78 °C (1-Buten)zirconocen, welches die Resonanzstrukturen A und B aufweist. Dieses Reagenz wurde von Negishi entwickelt.[5]

Eine größere Ausbeute als mit n-BuLi lässt sich mithilfe von Bis(trimethylsilyl)acetylen als erzielen. Dabei werden Zirconocenkomplexe wie folgt zum sogenannten Rosenthal-Reagenz mit den Grenzstrukturen A und B synthetisiert.[6] Neben der dargestellten allgemeinen Reaktion werden häufig verschieden substituierte Cyclopentadienyl-Liganden sowie zusätzliche Liganden (z. B. Pyridin) eingesetzt. Dadurch lassen sich Reaktionen mit den Metallocen-Komplexen gezielter steuern und das Reagenz wird außerdem lagerfähig.[7]
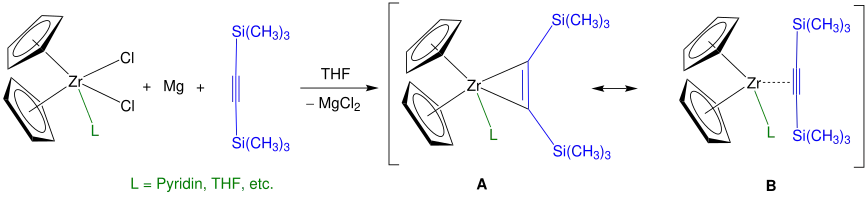
Anstelle von Zirconium kann auch Titan als Zentralatom eingesetzt werden, was eine analoge Bereitstellung von Titanocen ermöglicht.[7]
Reaktionen
Da das Zirconocenfragment nur über 14 Außenelektronen verfügt, gilt es als äußerst reaktionsfreudig. Es besitzt ein freies Elektronenpaar und zwei unbesetzte Valenzorbitale und kann damit bezüglich seiner Reaktivität mit den Carbenen verglichen werden.[2] Typische Reaktionen sind Kupplungs- und Insertionsreaktionen zu Metallacyclen, welche beispielsweise anhand der Addition von Kohlenstoffdioxid, Ketonen, Nitrilen oder Alkinen beobachtet werden können.[8]
Verwendung
Cp2ZrII-Verbindungen spielen eine wichtige Rolle in der organischen und anorganischen Synthese. Hervorzuheben sind dabei neuartige C-C-Kupplungsreaktionen, welche ein breites Spektrum an Möglichkeiten eröffnen. Insbesondere die Synthese präparativ anspruchsvoller organischer Strukturen und verschiedenster Heterometallacyclen kann in diesem Zusammenhang realisiert werden.[9] Besonders effizient hat sich hierbei die Verwendung des Rosenthal-Reagenzes erwiesen, da es sich durch eine hohe Selektivität auszeichnet und große Ausbeuten erzielt werden können.[6]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Uwe Rosenthal, Vladimir V. Burlakov: Organometallic Chemistry of Titanocene and Zirconocene Complexes with Bis(trimethylsilyl)acetylene as the Basis for Applications in Organic Synthesis. In: Ilan Marek (Hrsg.): Titanium and Zirconium in Organic Synthesis. Wiley-VCH, 2002, ISBN 3-527-30428-2, S. 355–389, doi:10.1002/3527600671.ch10.
- Ei-ichi Negishi, Jean-Luc Montchamp: Zirconocenes. In: Antonio Togni, Ronald L. Halterman (Hrsg.): Metallocenes. Wiley-VCH, 1998, doi:10.1002/9783527619542.ch5.
- Ei-ichi Negishi, Shouquan Huo: Synthesis and Reactivity of Zirconocene Derivatives. In: Ilan Marek (Hrsg.): Titanium and Zirconium in Organic Synthesis. Wiley-VCH, 2002, ISBN 3-527-30428-2, S. 1–2, doi:10.1002/3527600671.ch1.
- Ei-Ichi Negishi, Tamotsu Takahashi: Patterns of Stoichiometric and Catalytic Reactions of Organozirconium and Related Complexes of Synthetic Interest. In: Accounts of Chemical Research. Band 27, Nr. 5, Mai 1994, S. 124–130, doi:10.1021/ar00041a002.
- Jonathan R. Nitschke, Stefan Zürcher, T. Don Tilley: New Zirconocene-Coupling Route to Large, Functionalized Macrocycles. In: Journal of the American Chemical Society. Band 122, Nr. 42, Oktober 2000, S. 10345–10352, doi:10.1021/ja0020310.
- Uwe Rosenthal, Vladimir V. Burlakov, Perdita Arndt, Wolfgang Baumann, Anke Spannenberg: The Titanocene Complex of Bis(trimethylsilyl)acetylene: Synthesis, Structure, and Chemistry†. In: Organometallics. Band 22, Nr. 5, März 2003, S. 884–900, doi:10.1021/om0208570.
- Lisanne Becker, Uwe Rosenthal: Five-membered all-C- and hetero-metallacycloallenoids of group 4 metallocenes. In: Coordination Chemistry Reviews. Band 345, August 2017, S. 137–149, doi:10.1016/j.ccr.2016.07.008.
- U. Rosenthal: Reaktionen von Gruppe-4-Metallocen-Komplexen des Bis(trimethylsilyl)acetylens mit Nitrilen und Isonitrilen. In: Angewandte Chemie. 23. August 2018, doi:10.1002/ange.201805157.