Cyclopentadien
Cyclopentadien ist eine farblose Flüssigkeit. Es gehört der Kohlenwasserstoffgruppe der cyclischen Diene an.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
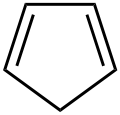 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclopentadien | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H6 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit terpen- bis campherartigem Geruch, durch Polymerisation zunehmend dunkler werdend[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 66,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,80 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
40 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,4440 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclopentadien findet sich im Steinkohlenteer. Es ist die Vorläufersubstanz des Cyclopentadienyl-Anions, das als Ligand (Cp) in Metallocenen (Sandwichverbindungen) in der metallorganischen Chemie weit verbreitet ist. Das bekannteste Beispiel ist der Eisenkomplex Ferrocen.
Chlorierte Produkte des Cyclopentadiens werden als Insektizide verwendet; aus Hexachlorcyclopentadien wird beispielsweise Dieldrin, Aldrin, Chlordan und Heptachlor hergestellt.
Gewinnung und Darstellung
Cyclopentadien kann durch thermische Spaltung aus Dicyclopentadien erhalten werden (Retro-Diels-Alder-Reaktion). In der Praxis wird es in Gegenwart eines Katalysators, beispielsweise Eisenpulver, aus seinem Dimer abdestilliert. Es muss jedoch schnell verbraucht werden, da es wieder zu Dicyclopentadien dimerisiert. Im Gefrierschrank ist es einige Zeit haltbar.
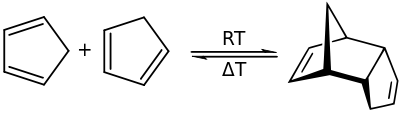
Eigenschaften
Cyclopentadien hat die starke Neigung spontan zu dimerisieren. So bildet sich bei 20 °C durch eine Diels-Alder-Reaktion das endo-Dicyclopentadien und bei 100 °C auch das exo-Dimer.[4]
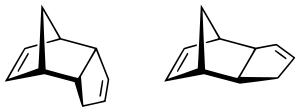
endo- (links) und exo-Form (rechts) des Dimers von Cyclopentadien
In Wasser ist Cyclopentadien unlöslich, in Ethanol, Benzol und Ether gut löslich. Der Flammpunkt liegt bei 25 °C, die Zündtemperatur bei 640 °C. Das Gefahrenpotenzial von Cyclopentadien wurde noch nicht ausreichend geprüft. Die Geruchsschwelle liegt bei 5,1–5,2 mg·m−3.
Cyclopentadienyl-Anion
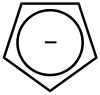
Anion
Aufgrund der Resonanzstabilisierung des Anions kann Cyclopentadien an der Methylengruppe durch Basen wie n-Butyllithium leicht deprotoniert werden. Auch eine direkte Metallierung mit Alkalimetallen ist möglich:
- Darstellung des Cyclopentadienyl-Anions
Mit einem pKs-Wert von 16,0[5] ist Cyclopentadien einer der acidesten Kohlenwasserstoffe. Das Cyclopentadienyl-Anion (auch: Cyclopentadienid-Anion, Abkürzung: Cp) besteht aus einem einfach negativ geladenen, aromatischen Fünfringsystem. Es bildet η5-Komplexverbindungen mit Metallkationen, beispielsweise Metallocene, Sandwich- oder Tripeldecker-Komplexe. Als η5-Ligand liefert das Cyclopentadienyl-Anion einem Komplex sechs Valenzelektronen.[6] Es sind jedoch auch η1-Komplexe (η3-Komplexe) bekannt, in denen der Cp-Ligand zwei bzw. vier Elektronen beiträgt.
Sicherheitshinweise
Da Cyclopentadien aufgrund seiner geringen Beständigkeit nur als Dicyclopentadien gehandelt und vertrieben wird, existieren für Cyclopentadien keine Gefahrstoffkennzeichnungs- und Transportvorschriften. Dennoch ist im Umgang mit dem Stoff Vorsicht geboten.
Cyclopentadien ist leichtentzündlich und sehr leicht flüchtig. Seine Dämpfe sind schwerer als Luft und bilden mit dieser explosionsfähige Gemische. Weiterhin reagiert es mit dem Luftsauerstoff und bildet explosive Peroxide. Auch mit einer Reihe anderer Chemikalien geht Cyclopentadien Reaktionen ein, bei denen es zu starker Hitzeentwicklung kommt und teils Entzündungs- oder Explosionsgefahr besteht.
Cyclopentadien wirkt reizend auf Augen, Atemwege und Haut und führt zu Störungen des Zentralnervensystems, in höheren Konzentrationen wirkt es narkotisierend. Aufgrund des deutlichen Geruchs ist mit einer versehentlichen Exposition gegenüber gefährlichen Konzentrationen des gasförmigen Stoffes nicht zu rechnen.
Einzelnachweise
- Eintrag zu 1,3-Cyclopentadien in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-130.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 542-92-7 bzw. Cyclopentadien), abgerufen am 2. November 2015.
- Eintrag zu Dicyclopentadien. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- Carey, Sundberg: Organische Chemie. VCH 1995.
- Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Tabelle Valenzelektronen in der Google-Buchsuche).

