Vanadium(IV)-chlorid
Vanadium(IV)-chlorid ist eine chemische Verbindung aus der Gruppe der Chloride. Sie liegt in Form einer instabilen, nicht brennbaren, rötlich braunen Flüssigkeit mit stechendem Geruch vor. Bei Einwirkung von Licht oder Luftfeuchtigkeit zersetzt sie sich unter Bildung von Chlorgas bzw. Chlorwasserstoff.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
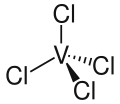 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Vanadium(IV)-chlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | VCl4 | ||||||||||||||||||
| Kurzbeschreibung |
rötlich-braune Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 192,75 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,82 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
154 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
zersetzt sich in Wasser mit heftiger Reaktion[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Vanadium(IV)-chlorid wird durch Chlorierung von Vanadium bei etwa 300–350 °C gewonnen.[2]
Eigenschaften
Vanadium(IV)-chlorid ist eine dunkelrotbraune, zähe, an Luft rauchende Flüssigkeit. Mit Wasser erfolgt Hydrolyse (blaue Lösung). Sie ist löslich in konzentrierter Salzsäure (braune Lösung) und Ether (tiefrote Lösung).[2] Vanadium(IV)-chlorid ist ein starkes Oxidationsmittel.
Vanadium(IV)-chlorid gibt bei Raumtemperatur langsam Chlor ab, da es in das Trichlorid disproportioniert[3]:
Dies kann zum Sprengen von fest verschlossenen Gefäßen führen. Ohne Gefahr einer Zersetzung lassen sich Lösungen in Kohlenstofftetrachlorid aufbewahren, aus denen es im Bedarfsfall durch Fraktionierung rein erhalten werden kann.[2]
Verwendung
Vanadium(IV)-chlorid wird zur Herstellung von anderen Vanadiumverbindungen, sowie bei organischen Synthesen und als Katalysator bei Polymerisationen von Alkenen verwendet. So zum Beispiel zur Kopplung von Phenolen:
Sicherheitshinweise
Vanadium(IV)-chlorid zersetzt sich in Wasser mit heftiger Reaktion. Die einatembaren Stäube von Vanadium und seinen anorganischen Verbindungen werden von der MAK-Kommission als krebserzeugend, Kategorie 2 und keimzellmutagen, Kategorie 2 eingestuft.[4]
Einzelnachweise
- Eintrag zu Vanadium(IV)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1412.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1548.
- Ständige Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: MAK- und BAT-Werte-Liste 2021. 57. Mitteilung. In: Deutsche Forschungsgemeinschaft (Hrsg.): Maximale Arbeitsplatzkonzentrationen und Biologische Arbeitsstofftoleranzwerte. Publisso, 2021, ISBN 978-3-9822007-1-2, doi:10.34865/mbwl_2021_deu.

