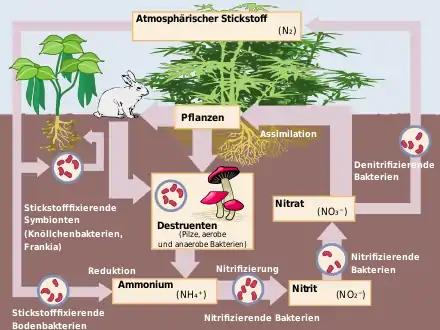
Stickstofffixierung
Unter Stickstofffixierung versteht man allgemein jegliche Umwandlung des chemisch inerten elementaren, molekularen Stickstoffs (N2). Die Stickstofffixierung ist der erste und grundlegende Schritt des Stickstoffkreislaufs.
Man unterscheidet:
- biotische Stickstofffixierung (durch Mikroorganismen)
- abiotische Stickstofffixierung (Bildung von Stickoxiden durch Verbrennungen oder Blitzschlag) und
- technische Stickstofffixierung (beispielsweise im Haber-Bosch-Verfahren).
Nach Schätzungen werden je Jahr etwa 200–300 Millionen Tonnen N2 biologisch fixiert, davon etwa ein Drittel in den Ozeanen. Im Vergleich dazu betrug die technische Fixierung (Haber-Bosch-Verfahren) von N2 im Jahr 1998 nur etwa 30 Millionen Tonnen.[1] Die symbiontischen Knöllchenbakterien fixieren etwa 50 – 150 kg Stickstoff je Hektar und Jahr und die freilebenden Bakterien nur 1 – 3 kg Stickstoff je Hektar und Jahr.
Die Stickstofffixierung ist zu unterscheiden von der „Ammoniumfixierung“, der Bindung von positiv geladenen Ammoniumionen an negativ geladene Tonminerale im Boden (siehe dazu Nährstoff (Pflanze) und Kationenaustauschkapazität).
Geschichte
Der russische Mikrobiologe Winogradski erbrachte erstmals den Nachweis der Stickstoffbindung bei einer Kultur von Clostridium pasteurianum (Bacillus amylobacter)[2] (veraltete Namen für Clostridium butyricum siehe dazu Buttersäuregärung).
Biotische Stickstofffixierung
Durch einige prokaryotische Mikroorganismen wird elementarer, molekularer Stickstoff (N2) zu Verbindungen reduziert, die reaktiver und insbesondere bioverfügbar sind.
Die Umsetzung wird durch das Enzym Nitrogenase katalysiert und ist aufgrund der sehr stabilen Dreifachbindung molekularen, elementaren Stickstoffs mit 946 Kilojoule je Mol (kJ/mol) (unter Standardbedingungen für Biologie) sehr energieaufwändig. Soweit bisher bekannt ist, werden zugleich mit der Reduktion eines Moleküls N2 zu Ammoniak (NH3) zwangsläufig auch noch 2 Wasserstoff-Ionen (H+) zu molekularem Wasserstoff (H2) reduziert, vermutlich für die Initiation der N2-Reduktion. Die N2-Reduktion verläuft in drei Schritten, bei denen jeweils 2 H-Atome angefügt werden: N2 → NH=NH → NH2-NH2 → 2 NH3. Die gesamte Umsetzung ist sehr energieaufwendig, die Energie wird – wie bei den meisten endergonen Stoffwechselreaktionen – durch die Hydrolyse von Adenosintriphosphat (ATP) zu Adenosindiphosphat (ADP) und ortho-Phosphat (Pi) zur Verfügung gestellt. Die Gleichung für die Reduktion von N2 und H+ zu NH3 und H2 bei Zurverfügungstellung der erforderlichen Energie durch die Hydrolyse von ATP zu ADP + Pi lautet:
Für die Bildung der erforderlichen Reduktionsäquivalente, hier als Elektronen (e-) dargestellt, ist als Energiequelle jeweils die Hydrolyse von 3 ATP zu 3 ADP + 3 Pi erforderlich, für 8 e- also die Hydrolyse von 8 × 3 = 24 ATP. Für die Bildung von 2 Mol NH3 und 1 Mol H2 nach der obigen Reaktionsgleichung müssen also 16 + 24 = 40 Mol ATP zu ADP + Pi hydrolysiert werden. Bei einigen N2-Reduzierern (beispielsweise Klebsiella pneumoniae) bleibt das so, das gebildete H2 entweicht. Einige (beispielsweise Azotobacter) können aber danach das gebildete H2 wieder zu 2 H+ oxidieren, wobei die dabei freigesetzte Energie zur Phosphorylierung von ADP zu ATP verwendet wird, diese N2-Reduzierer brauchen also etwas weniger als 40 ATP für die N2-Reduktion.[3]

Als Mikroorganismen, die Stickstoff fixieren können (Stickstofffixierer), sind bisher nur Prokaryoten bekannt, sie sind entweder freilebend oder leben in Symbiose mit Pflanzen. Bekannte freilebende Vertreter sind die Gattungen Azotobacter, Azomonas und Cyanobakterien (früher Blaualgen genannt). Cyanobakterien fixieren den Stickstoff oft in spezialisierten Zellen, sogenannten Heterozysten.
Weitere Beispiele sind:[2] Aerobacter, Achromobacter, Bacillus polymixa (siehe Bacillus), Pseudomonas, Clostridium pasteurianum (veralteter Namen für Clostridium butyricum, siehe dazu Buttersäuregärung), Methanobacterium (siehe Methanbildner), Desulfovibrio, Rhodospirillum, Chromatium (siehe Schwefeloxidierende Bakterien), Chlorobium (siehe Grüne Schwefelbakterien), Rhodomicrobium (siehe Eisenoxidierende Mikroorganismen), Anabaena, Calothrix, Nostoc und Tolypothrix.
Die bekanntesten symbiotisch lebenden Stickstofffixierer sind Knöllchenbakterien (beispielsweise bei Leguminosen) und Frankia (bei verholzenden Pflanzen wie Erlen).
Da die Stickstofffixierung für die Lebewesen sehr energieaufwändig ist, wird sie streng reguliert und kommt nur zur Anwendung, wenn das Lebewesen keine andere Möglichkeit zur Stickstoffversorgung hat.
Die Spurenelemente Molybdän und Vanadium (und Wolfram als Ersatzstoff) wurden als notwendige Agentien für die Stickstoff-Fixierung durch Azotobacter eruiert.[4][5][6]
Von einigen Autoren wurde Stickstoff-Fixierung zur körpereigenen Protein-Biosynthese auch bei Insekten (bei Blattläusen und Gleichflüglern) nachgewiesen.[7]
Abiotische Stickstofffixierung
Durch Blitzschlag bei Gewittern, Verbrennung und Vulkane: aus Stickstoff und Sauerstoff der Luft entstehen Stickoxide, die mit Wassertröpfchen in der Atmosphäre zu Salpetriger Säure bzw. Salpetersäure reagieren und als Teil des sauren Regens in den Boden gelangen.
Technische Stickstofffixierung
Nach dem Haber-Bosch-Verfahren kann N2 reduziert werden. Der Prozess benötigt eine Temperatur von 500 °C, einen Druck von 450 bar und Katalysatoren. Die Reduktion ist ähnlich wie unter (2). Meist wird dieser Ammoniak in nitrathaltige Düngemittel umgesetzt.
Bei der Azotierung wird Stickstoff zur Darstellung von Kalkstickstoff gemäß folgender Reaktionsgleichung fixiert:
Weitere Bedeutung
Zudem wird mit Stickstofffixierung die Festlegung des Bodenstickstoffs in der organischen Substanz bezeichnet, wenn ein ungünstiges Kohlenstoff-Stickstoff-Verhältnis (C/N-Verhältnis) vorliegt. Der Grund liegt hierbei im Stickstoffbedarf der abbauenden Mikroorganismen. So lässt sich bei der Ausbringung stickstoffarmer Mulchmaterialien wie Sägespäne, Holzhäcksel oder Rindenhäcksel ein Stickstoffmangel der Kulturpflanzen beobachten. Daher kann es günstig sein, solche Materialien vorher zu kompostieren, oder zusätzlich einen Stickstoffdünger zu geben. Der gebundene Stickstoff wird mit dem Abbau der organischen Stoffe langfristig wieder freigesetzt.
Literatur
- Eintrag zu Stickstoff-Fixierung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
Einzelnachweise
- Stickstoffixierung - Lexikon der Biologie. In: spektrum.de. Spektrum Verlag, abgerufen am 14. Februar 2016.
- Ruth Beutler: Der Stoffwechsel. Springer-Verlag, 2013, ISBN 978-3-662-37018-6, S. 988 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. L. Slonczewski, John W. Foster: Mikrobiologie - Eine Wissenschaft mit Zukunft (Übersetzung aus dem Englischen). 2. Auflage. Springer Spektrum, Berlin, Heidelberg 2012, ISBN 978-3-8274-2909-4, S. 660–662.
- H. Bortels: Molybdän als Katalysator bei der biologischen Stickstoffbindung. In: Archiv für Mikrobiologie. Band 1, Nr. 1, 1. Januar 1930, S. 333–342, doi:10.1007/BF00510471.
- H. Bortels: Über die Wirkung von Molybdän- und Vanadiumdüngungen auf Azotobacter-Zahl und Stickstoffbindung in Erde. In: Archiv für Mikrobiologie. Band 8, Nr. 1-4, 1. Januar 1937, S. 1–12, doi:10.1007/BF00407188.
- E. Blanck: Handbuch der Bodenlehre. Springer, Berlin 1939, ISBN 978-3-642-99617-7, S. 525 (eingeschränkte Vorschau in der Google-Buchsuche).
- L. Tóth, A. Wolsky, M. Bátori: Stickstoffbindung aus der Luft bei den Aphiden und bei den Homopteren (Rhynchota insecta). In: Zeitschrift für Vergleichende Physiologie. Band 30, Nr. 1, 1. Dezember 1943, S. 67–73, doi:10.1007/BF00338578.