5-Aminolävulinsäure
5-Aminolävulinsäure (5-ALA) ist eine Aminosäure aus der Gruppe der Ketocarbonsäuren. Als Gel Ameluz[3] und als Arzneimittelpflaster Alacare[4] ist sie zur Behandlung aktinischer Keratosen mittels photodynamischer Therapie (PDT) und als Gliolan[5] zur Fotodiagnostik (FD) zugelassen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
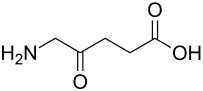 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 5-Aminolävulinsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C5H9NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XD04 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 131,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| Löslichkeit |
gut in Wasser (50 g·l−1, Hydrochlorid)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Außer durch chemische Verfahren kann 5-Aminolävulinsäure auch durch biotechnologische Verfahren mit Hilfe von Bakterien (Rhodobakterium, Propionibakterium, Methanobakterium, Methanosarcina und ähnlichen) hergestellt werden.[6]
Biologische Bedeutung
5-Aminolävulinsäure ist eine Vorstufe des Häm in der Porphyrinsynthese. Hierbei reagieren zwei Moleküle unter Abspaltung von Wasser zu Porphobilinogen:

Das Ion δ-Aminolävulinat entsteht in einer durch das mitochondriale Enzym δ-Aminolävulinatsynthase katalysierten Reaktion aus Succinyl-CoA und der Aminosäure Glycin:
- Succinyl-CoA + Glycin → δ-Aminolävulinat + CO2 + CoA
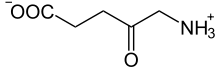 δ-Aminolävulinat (Zwitterion)
δ-Aminolävulinat (Zwitterion)
Das benötigte Succinyl-CoA entstammt dem Citratzyklus, Glycin der Biosynthese aus Serin. Im weiteren Verlauf der Hämbiosynthese reagieren zwei Moleküle δ-Aminolävulinat zum sogenannten Porphobilinogen (PBG) und zwei Wassermolekülen. Diese Reaktion wird vom Enzym δ-Aminolävulinsäure-Dehydratase (synonym: Porphobilinogen-Synthase) katalysiert.
- 2 δ-Aminolävulinat → PBG + 2 H2O
Das entstehende Porphobilinogen wird dann vom Mitochondrium ins Zytosol transportiert. Hier wird über drei weitere Zwischenstufen aus vier Molekülen Porphobilinogen das für die photodynamische Therapie bedeutsame Protoporphyrin IX gebildet.
Pharmakologische Wirkung
5-ALA reichert sich in Tumorzellen und tumorartigen Zellen stärker an als in gesunden Zellen und wird dort zu Protoporphyrin IX umgesetzt.[7] Die daraus resultierende vermehrte Anreicherung des rot fluoreszierenden Moleküls Protoporphyrin IX in diesen Zellen wird in der Tumordiagnostik und der photodynamischen Therapie (PDT) genutzt. Zusätzlich zur vermehrten Anreicherung von 5-ALA in Tumorzellen ist die Synthese des Photosensibilisators Protoporphyrin IX aus 5-ALA im Vergleich zu gesunden Zellen begünstigt, da bestimmte Stoffwechselvorstufen des Protoporphyrin IX, Porphobilinogen und Uroporphyrinogen III, verstärkt gebildet werden.[8][9][10] Dahingegen ist der Abbau von Protoporphyrin IX zu Häm durch eine geringere Aktivität der Ferrochelatase in Tumorzellen gegenüber gesunden Zellen vermindert.[7][11][12] Durch die externe Zugabe von 5-ALA als Arzneimittel wird zusätzlich die Endprodukthemmung von Häm auf die 5-ALA-Synthase der Zelle umgangen.[12][13] Protoporphyrin IX wird in verschiedenen Zelltypen effizienter aus 5-ALA synthetisiert als aus ihrem Methylester (MAOP).[14][15][16][17][18][19][20] In einer Untersuchung an Hautzellen wurde nachgewiesen, dass sich Protoporphyrin IX aus 5-ALA nach einer für die photodynamische Therapie relevanten Einwirkzeit viermal stärker in Hauttumorzellen gegenüber gesunden Zellen anreicherte.[20] Dabei war die Anreicherung aus 5-ALA in den Tumorzellen fast doppelt so hoch wie diejenige aus MAOP, in gesunden Zellen aber für beide Wirkstoffe gleich niedrig.[20] Die stärkere Anreicherung von Protoporphyrin IX in Tumorzellen wird in der photodynamischen Therapie genutzt, um diese selektiv abzutöten. Durch Belichtung mit geeigneten Lichtquellen nimmt Protoporphyrin IX Lichtenergie auf und überträgt sie auf Sauerstoff, der zum sehr reaktiven, toxischen Singulett-Sauerstoff wird. Dadurch wird das Tumorgewebe, in dem das Protoporphyrin IX bevorzugt gebildet wurde, spezifisch zerstört, wohingegen gesunde Zellen weitgehend verschont bleiben.
Verwendung
Hirntumore
Die intrazelluläre Anreicherung im bösartigen Hirntumor Glioblastom und dortige Umwandlung zu Protoporphyrin IX ermöglicht intraoperativ eine bessere Abgrenzung des Tumorrandes zum angrenzenden Hirngewebe und erleichtert hierdurch die Tumorresektion.[21] Dazu wird 5-ALA circa 2 bis 4 Stunden vor der Operation eingenommen.[5] Wegen möglicher Hautschäden durch Photosensitivität sollen die Patienten für 24 Stunden keinen starken Lichtquellen (z. B. OP-Beleuchtung, direktes Sonnenlicht oder helle, intensive Innenbeleuchtung) ausgesetzt werden.[22]
Hauttumore
Äußerlich ist 5-ALA im Rahmen der photodynamischen Behandlung der leichten bis mittelschweren aktinischen Keratose, einer häufigen, durch intensive Einwirkung von UV-Strahlung verursachten Präkanzerose angezeigt.[3][4] Die photodynamische Therapie stellt die erfolgreichste verfügbare Behandlung der aktinischen Keratose dar und ist darum in den dermatologischen Leitlinien als erste Therapiewahl empfohlen.[23][24] Zur Behandlung der aktinischen Keratose ist 5-ALA als Arzneipflaster oder als Gel zugelassen.[3][4] Durch die im Gel enthaltene Nanoemulsion wird die geringe Stabilität und Hautpenetration von 5-ALA gegenüber herkömmlichen Emulsionen erheblich verbessert.[25] Das Arzneimittel wird auf die Hautveränderungen aufgebracht und der so behandelte Bereich nach 3 bis 4 Stunden Einwirkzeit für 10 bis 20 Minuten mit einer kalten Rotlichtquelle beleuchtet.[3][4]
Bei den meisten Patienten (bis 80 %) treten als Nebenwirkungen der photodynamischen Therapie mit 5-ALA lokale Hautreizungen in Form von Erythemen und Ödemen sowie Schmerzen während und kurz nach der Behandlung auf.[26][27][28] In den Tagen nach der Behandlung entsteht zumeist eine kurzfristige sterile und damit unbedenkliche Entzündung der behandelten Haut, die wahrscheinlich wesentlich zum Behandlungserfolg beiträgt.[29][30] Währenddessen durchläuft die Haut Regenerationsprozesse und eine vermehrte Bildung von Kollagen, die für das gute kosmetische Ergebnis der Therapie mitverantwortlich sind.[31] Die PDT hinterlässt keine Narben. Im direkten Vergleich wurde ein signifikant höherer Heilungserfolg für die photodynamische Therapie mit 5-ALA gegenüber derjenigen mit MAOP dokumentiert, bei gleicher Häufigkeit und Intensität der durch die Behandlung verursachten Nebenwirkungen wie Rötung und Schmerzen.[26] Nach einem Beobachtungszeitraum von 12 Monaten zeigte sich eine geringere Rückfallrate für Patienten, die PDT mit 5-ALA erhalten hatten gegenüber Patienten, die mit MAOP behandelt wurden.[32]
Bei einer akuten Bleivergiftung gilt ein erhöhter Spiegel der 5-Aminolävulinsäure im Urin als empfindliches Nachweisverfahren.[33][34]
5-ALA wurde traditionell häufig in Rezepturen eingesetzt. Dies ist nach neuerer Rechtslage jedoch rechtlich bedenklich und zieht mögliche Haftungsrisiken für Arzt und Apotheker nach sich. Es stehen zugelassene Fertigarzneimittel mit 5-ALA mit verbesserter Stabilität und wissenschaftlich geprüfter hoher Wirksamkeit zur Verfügung. Im Neuen Rezeptur-Formularium (NRF) der Bundesvereinigung Deutscher Apothekerverbände (ABDA) ist aufgrund der hohen Instabilität von 5-ALA in herkömmlichen Rezepturgrundlagen keine Monografie zur Herstellung von ALA-Rezepturen hinterlegt. Gemäß einer Resolution des Ministerrats der Europäischen Union vom 19. Januar 2011 muss das äquivalente, zugelassene Fertigarzneimittel an Stelle einer Rezeptur verwendet werden, wenn kein klinisch oder wissenschaftlich begründbarer Zusatznutzen der Rezeptur vorliegt. Daher wird vor dem Einsatz von ALA-Rezepturen zunehmend gewarnt.[35]
Agrarwirtschaftlich
5-Aminolävulinsäure wird als Düngemittel in der Landwirtschaft eingesetzt.[36]
Fertigarzneimittel
Alacare (D), Ameluz (EU), Gliolan (EU)
Weblinks
- Kubisches Gel und Pflaster: Konkurrierende Darreichungsformen für 5-Aminolävulinsäure (PDF; 35 kB)
- Daniela Steinat: Bewertung der Photodynamischen Diagnostik mit 5-Aminolävulinsäure beim Basalzellkarzinom durch 3-D-Histologie. urn:nbn:de:bsz:21-opus-15597
- Öffentlich zugängliche Zulassungsdaten für Ameluz® European Medical Association (EMA)
Einzelnachweise
- Datenblatt 5-Aminolevulinic acid hydrochloride bei Sigma-Aldrich, abgerufen am 5. Februar 2018 (PDF).
- Eintrag zu 5-Amino-4-oxopentansäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Dezember 2014.
- Ameluz 78 mg/g Gel, Zusammenfassung der Merkmale des Arzneimittels, Stand März 2013.
- Fachinformation Alacare 8 mg wirkstoffhaltiges Pflaster, Stand Februar 2011.
- Fachinformation Gliolan 30 mg/ml (PDF; 354 kB) Stand Juli 2012.
- Patent DE69829765T2: Mikroorganismen, welche 5-Aminolävulinat herstellen und Verfahren zur Herstellung von 5-Aminolävulinat unter Verwendung derselben. Angemeldet am 27. Mai 1998, veröffentlicht am 2. März 2006, Anmelder: Cosmo Oil Co Ltd, Cosmo Research Institute, Erfinder: Seiji Nishikawa et al.
- R Van Hillegersberg, JW Van den Berg, WJ Kort, OT Terpstra, JH. Wilson: Selective accumulation of endogenously produced porphyrins in a liver metastasis model in rats. In: Gastroenterology. 1992 Aug, 103(2), S. 647–651, PMID 1386052.
- M Kondo, N Hirota, T Takaoka, M. Kajiwara: Heme-biosynthetic enzyme activities and porphyrin accumulation in normal liver and hepatoma cell lines of rat. In: Cell Biol Toxicol., 1993 Jan-Mar, 9(1), S. 95–105, PMID 8390914.
- L Leibovici, N Schoenfeld, HA Yehoshua, R Mamet, E Rakowsky, A Shindel, A. Atsmon: Activity of porphobilinogen deaminase in peripheral blood mononuclear cells of patients with metastatic cancer. In: Cancer. 1988 Dec 1, 62(11), S. 2297–2300, PMID 3179945.
- N Schoenfeld, O Epstein, M Lahav, R Mamet, M Shaklai, A. Atsmon: The heme biosynthetic pathway in lymphocytes of patients with malignant lymphoproliferative disorders. In: Cancer Lett., 1988 Dec 1, 43(1-2), S. 43–48, PMID 3203329.
- MM el-Sharabasy, AM el-Waseef, MM Hafez, SA. Salim: Porphyrin metabolism in some malignant diseases. In: Br J Cancer. 1992 Mar, 65(3), S. 409–412, PMID 1558795.
- Q Peng, K Berg, J Moan, M Kongshaug, JM. Nesland: 5-Aminolevulinic acid-based photodynamic therapy: principles and experimental research. In: Photochem Photobiol., 1997 Feb, 65(2), S. 235–251, PMID 9066303.
- MA. MacCormack: Photodynamic therapy in dermatology: an update on applications and outcomes. In: Semin Cutan Med Surg. 2008 Mar, 27(1), S. 52–62, PMID 18486025.
- R Washbrook, H Fukuda, A Battle, P. Riley: Stimulation of tetrapyrrole synthesis in mammalian epithelial cells in culture by exposure to aminolaevulinic acid. In: Br J Cancer. 1997, 75(3), S. 381–387, PMID 9020483.
- P Uehlinger, M Zellweger, G Wagnières, L Juillerat-Jeanneret H, van den Bergh, N. Lange: 5-Aminolevulinic acid and its derivatives: physical chemical properties and protoporphyrin IX formation in cultured cells. In: J Photochem Photobiol B., 2000 Jan, 54(1), S. 72–80, PMID 10739146.
- JM Gaullier, K Berg, Q Peng, H Anholt, PK Selbo, LW Ma, J. Moan: Use of 5-aminolevulinic acid esters to improve photodynamic therapy on cells in culture. In: Cancer Res., 1997 Apr 15, 57(8), S. 1481–1486, PMID 9108449.
- RG Tunstall, AA Barnett, J Schofield, J Griffiths, DI Vernon, SB Brown, DJ. Roberts: Porphyrin accumulation induced by 5-aminolaevulinic acid esters in tumour cells growing in vitro and in vivo. In: Br J Cancer., 2002 Jul 15, 87(2), S. 246–250, PMID 12107850.
- L Rodriguez, A Battle, G Di Venosa, AJ MacRobert, S Battah, H Daniel, A. Casas: Study of the mechanisms of uptake of 5-aminolevulinic acid derivatives by PEPT1 and PEPT2 transporters as a tool to improve photodynamic therapy of tumours. In: Int J Biochem Cell Biol. 2006, 38(9), S. 1530–1539, PMID 16632403.
- JB Lee, JY Choi, JS Chun, SJ Yun, SC Lee, J Oh, HR. Park: Relationship of protoporphyrin IX synthesis to photodynamic effects by 5-aminolaevulinic acid and its esters on various cell lines derived from the skin. In: Br J Dermatol., 2008 Jul, 159(1), S. 61–67, PMID 18489589.
- R Schulten, B Novak, B Schmitz, H. Lübbert: Comparison of the uptake of 5-aminolevulinic acid and its methyl ester in keratinocytes and skin. In: Naunyn Schmiedebergs Arch Pharmacol., 2012 Oct, 385(10), S. 969–979, PMID 22801976.
- Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. In: Lancet Oncol. 2006, 7, S. 392–401.
- Fachinformation Gliolan 30 mg/ml Stand 02/2014 www.fachinfo.de abgerufen 9. Oktober 2017.
- LR Braathen, RM Szeimies, N Basset-Seguin, R Bissonnette, P Foley, D Pariser, R Roelandts, AM Wennberg, CA. Morton: Guidelines on the use of photodynamic therapy for nonmelanoma skin cancer: an international consensus. International Society for Photodynamic Therapy in Dermatology, 2005. In: J Am Acad Dermatol 2007, 56, S. 125–143, PMID 17190630.
- CA. Morton, RM Szeimies, A Sidoroff, LR. Braathen: European guidelines for topical photodynamic therapy part 1: treatment delivery and current indications - actinic keratoses, Bowen’s disease, basal cell carcinoma. In: J Eur Acad Dermatol Venereol., 2013 May, 27(5), S. 536–544, PMID 23181594.
- T Maisch, F Santarelli, S Schreml, P Babilas, RM. Szeimies: Fluorescence induction of protoporphyrin IX by a new 5-aminolevulinic acid nanoemulsion used for photodynamic therapy in a full-thickness ex vivo skin model. In: Experimental Dermatology, 2010, 19, S. e302-e305, PMID 19845760.
- T Dirschka, P Radny R, Dominicus, H Mensing, H Brüning, L Jenne, L Karl, M Sebastian, C Oster-Schmidt, W Klövekorn, U Reinhold, M Tanner, D Gröne, M Deichmann, M Simon, F Hübinger, G Hofbauer, G Krähn-Senftleben, F Borrosch, K Reich, C Berking, P Wolf, P Lehmann, M Moers-Carpi, H Hönigsmann, K Wernicke-Panten, S Hahn, G Pabst, D Voss, M Foguet, B Schmitz, H Lübbert RM, Szeimies: Photodynamic therapy with BF-200 ALA for the treatment of actinic keratosis: results of a multicentre, randomized, observer-blind phase III study in comparison with a registered methyl-5-aminolaevulinate cream and placebo. AK-CT002 Study Group, AK-CT003 Study Group. In: Br J Dermatol., 2012 Apr, 168(4), S. 825–836, PMID 21910711.
- RM Szeimies, P Radny, M Sebastian, F Borrosch, T Dirschka, G Krähn-Senftleben, K Reich, G Pabst, D Voss, M Foguet, R Gahlmann, H Lübbert, U. Reinhold: Photodynamic therapy with BF-200 ALA for the treatment of actinic keratosis: results of a prospective, randomized, double-blind, placebo-controlled phase III study. In: Br J Dermatol., 2010 Aug, 163(2), S. 386–394, PMID 20518784.
- A Hauschild, E Stockfleth, G Popp, F Borrosch, H Brüning, R Dominicus, H Mensing, U Reinhold, K Reich, AC Moor, M Stocker, C Ortland, M Brunnert, RM. Szeimies: Optimization of photodynamic therapy with a novel self-adhesive 5-aminolaevulinic acid patch: results of two randomized controlled phase III studies. In: Br J Dermatol., 2009 May, 160(5), S. 1066–1074, PMID 19222455.
- G Dragieva, BM Prinz, J Hafner, R Dummer, G Burg, U Binswanger, W. Kempf: A randomized controlled clinical trial of topical photodynamic therapy with methyl aminolaevulinate in the treatment of actinic keratoses in transplant recipients. In: Br J Dermatol., 2004 Jul, 151(1), S. 196–200, PMID 15270891.
- AR Oseroff, S Shieh, NP Frawley, R Cheney, LE Blumenson, EK Pivnick, DA. Bellnier: Treatment of diffuse basal cell carcinomas and basaloid follicular hamartomas in nevoid basal cell carcinoma syndrome by wide-area 5-aminolevulinic acid photodynamic therapy. In: Arch Dermatol., 2005 Jan, 141(1), S. 60–67, PMID 15655143.
- S Karrer, E Kohl, K Feise, D Hiepe-Wegener, S Lischner, W Philipp-Dormston, M Podda, W Prager, T Walker, RM. Szeimies: Photodynamic therapy for skin rejuvenation: review and summary of the literature – results of a consensus conference of an expert group for aesthetic photodynamic therapy. In: J Dtsch Dermatol Ges., 2013 Feb, 11(2), S. 137–148, PMID 23190505.
- T Dirschka, P Radny, R Dominicus, H Mensing, H Brüning, L Jenne, L Karl, M Sebastian, C Oster-Schmidt, W Klövekorn, U Reinhold, M Tanner, D Gröne, M Deichmann, M Simon, F Hübinger, G Hofbauer, G Krähn-Senftleben, F Borrosch, K Reich, C Berking, P Wolf, P Lehmann, M Moers-Carpi, H Hönigsmann, K Wernicke-Panten, S Hahn, G Pabst, D Voss, M Foguet, B Schmitz, H Lübbert RM, Szeimies: Long-term (6 and 12 months) follow-up of two prospective, randomized, controlled phase III trials of photodynamic therapy with BF-200 ALA and methyl aminolaevulinate for the treatment of actinic keratosis. AK-CT002 Study Group, AK-CT003 Study Group. In: Br J Dermatol., 2013 Apr, 168(4), S. 825–836, PMID 23252768.
- Jan Koolman, Klaus-Heinrich Röhm: Taschenatlas der Biochemie. 3. Auflage. Georg Thieme Verlag, 2003, ISBN 978-3-13-759403-1, S. 192.
- Rainer Braun: Spezielle Toxikologie für Chemiker: eine Auswahl toxischer Substanzen. Vieweg+Teubner Verlag, 1999, ISBN 978-3-519-03538-1, S. 38.
- Resolution CM/ResAP(2011)1 on quality and safety assurance requirements for medicinal products prepared in pharmacies for the special needs of patients. Council of Ministers of the European Union, 19. Januar 2011.
- 5-Aminolävulinsäure als Düngemittel (Pentakeep) (PDF; 266 kB).