Vanadium(V)-oxidtrichlorid
Vanadium(V)-oxidtrichlorid ist eine chemische Verbindung, die in Form einer gelben hygroskopischen Flüssigkeit vorliegt, welche schnell hydrolysiert.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
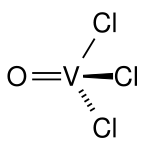 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Vanadium(V)-oxidtrichlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | VOCl3 | ||||||||||||||||||
| Kurzbeschreibung |
gelbe hygroskopische Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 173,30 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,83 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
126,7 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
aufgehoben, da karzinogen[1] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Vanadium(V)-oxidtrichlorid wird durch die Chlorierung von Vanadium(V)-oxid oder Vanadium(III)-oxid synthetisiert.[2]
Ebenfalls möglich ist die Darstellung durch Erhitzen von Vanadium(III)-chlorid im Sauerstoffstrom.[2]
Eigenschaften
Physikalische Eigenschaften
Vanadium(V)-oxidtrichlorid ist als Vanadiumverbindung diamagnetisch und hat eine tetragonale Struktur mit einem O–V–Cl Bindungswinkel von 111° und einem Cl–V–Cl Bindungswinkel von 108°. Die V–O- und V–Cl-Bindungslängen betragen 1,57 Å und 2,14 Å.
Chemische Eigenschaften
Vanadium(V)-oxidtrichlorid ist chemisch Phosphoroxychlorid POCl3 ähnlich, im Gegensatz dazu aber ein starkes Oxidationsmittel. Es ist eine Lewis-Säure und hydrolysiert schnell zu Vanadiumpentoxid und Salzsäure.
Vanadium(V)-oxidtrichlorid wird auch zur Synthese von Vanadiumoxiddichlorid und Vanadiumoxidmonochlorid eingesetzt.
Verwendung

Vanadium(V)-oxidtrichlorid wird als Katalysator für Olefin-Polymerisationen (z. B. EPDM) und als Oxidationsmittel zur Synthese von Organovanadiumverbindungen und Kupplungsreaktionen von Phenolen verwendet.
Sicherheitshinweise
Vanadium(V)-oxidtrichlorid ist als krebserzeugend eingestuft.
Einzelnachweise
- Eintrag zu Vanadium(V)-oxidtrichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1417.
- Datenblatt Vanadium (V) trichloride oxide (PDF) bei Strem, abgerufen am 21. April 2016.
- Rolf B. Johannsen: Vanadium oxytrichloride [Vanadyl(V) chloride]. In: Eugene G. Rochow (Hrsg.): Inorganic Syntheses. Band 6. McGraw-Hill Book Company, Inc., 1960, S. 119–120 (englisch).

