Vanadium(II)-chlorid
Vanadium(II)-chlorid ist eine anorganische chemische Verbindung aus der Gruppe der Chloride. Es ist ein blassgrüner Feststoff, der ab 910 °C sublimiert.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ V2+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Vanadium(II)-chlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | VCl2 | |||||||||||||||
| Kurzbeschreibung |
blassgrüner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 121,85 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,23 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
ab 910 °C Sublimation[1] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Durch Reduktion von Vanadium(II)-chlorid mit Wasserstoff konnte von Henry Enfield Roscoe 1867 erstmals metallisches Vanadium hergestellt werden.
Gewinnung und Darstellung
Vanadium(II)-chlorid kann durch Reduktion von Vanadium(III)-chlorid durch Erhitzung (~675 °C) im Beisein von sauerstofffreiem Wasserstoff gewonnen werden.[4]
Auch die Disproportionierung von Vanadium(III)-chlorid in Stickstoff[4]
oder die direkte Reaktion von Vanadium mit Chlor sind möglich.[4]
Eigenschaften
Vanadium(II)-chlorid liegt als hellgrüne Blättchen vor. Es ist weniger hygroskopisch als Vanadium(III)- und Vanadium(IV)-chlorid und löst sich in Alkohol oder Ether[4] unter Bildung von blauen bzw. gelb-grünen Lösungen[2]. Bei Lösung in Wasser bildet sich das violette [V(H2O)6]2+ Ion, welches bereits durch Luftsauerstoff oxidiert wird[2].
Es ist ein starkes Reduktionsmittel, mit welchem die Reduktion von Sulfoxiden zu Sulfiden, organische Aziden zu Aminen sowie die reduktive Kopplung einiger Alkylhalogenide möglich ist.
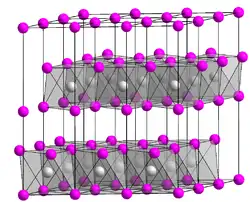
Vanadium(II)-chlorid besitzt eine trigonale Kristallstruktur mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164), entsprechend der von Cadmiumiodid in der gleichen Raumgruppe.[4]
Einzelnachweise
- Webelements: Vanadiumdichloride
- Ralph C. Young and Maynard E. Smith: Vanadium(II) chloride. In: J. C. Bailar, Jr. (Hrsg.): Inorganic Syntheses. Band 4. McGraw-Hill, Inc., 1953, S. 126–127 (englisch).
- Datenblatt Vanadium(II) chloride bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1408.

