Cholesterin
Das Cholesterin, auch genauer Cholesterol (von griechisch χολή cholé, deutsch ‚Galle‘, und von στερεός stereós, deutsch ‚fest, hart, verhärtet‘), ist ein in allen tierischen Zellen vorkommender fettartiger Naturstoff. Der Stoff wurde im 18. Jahrhundert in kristalliner Form in Gallensteinen gefunden, weshalb der französische Chemiker Eugène Chevreul, Begründer der Fettchemie, 1824 den Namen „cholestérine“ prägte. Die Substanz wird bei Tieren in der Leber produziert und ist außer in der Gallenflüssigkeit auch im Blut und in Geweben zu finden, besonders reichlich im Nervengewebe. Cholesterin hat Einfluss auf die Stabilisierung von Zellmembranen, die Nervenfunktion, die Produktion von Sexualhormonen und andere Prozesse.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
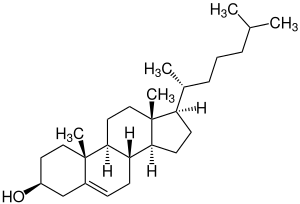 Strukturformel von Cholesterin | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cholesterin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C27H46O | |||||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 386,67 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,07 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung bei >200 °C[2] | |||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
_02.jpg.webp)
In geringer Menge ist Cholesterin auch in pflanzlichen Zellen (Kartoffelkraut, Pollen, isolierte Chloroplasten) und in Bakterien enthalten.[3] Besonders cholesterinreiche Pflanzenöle sind Maiskeimöl (55 mg pro kg), Rapsöl (53 mg pro kg) und Baumwollsamenöl (45 mg pro kg). Typische Cholesterinquellen tierischer Herkunft enthalten ein Vielfaches dieser Menge.[4] Ein typischer Wert für Butter beträgt zum Beispiel 2340 mg pro kg.[5]
Funktion
Cholesterin ist ein lebenswichtiges Sterol und ein wichtiger Bestandteil der Zellmembran. Es erhöht die Stabilität der Membran und trägt gemeinsam mit Proteinen dazu bei, Signalstoffe in die Zellmembran einzuschleusen und wieder hinauszubefördern. Der menschliche Körper enthält etwa 140 g Cholesterin, über 95 % des Cholesterins befindet sich innerhalb der Zellen und Zellmembranen. Um die Zellen mit Cholesterin, welches lipophil (fettlöslich) sowie hydrophob (wasserabweisend bei Benetzung) ist, über das Blut versorgen zu können, wird es für den Transport an Lipoproteine gebunden. Diese können von unterschiedlicher Dichte sein und werden nach ihrem Verhalten beim Zentrifugieren bzw. in der Elektrophorese unterteilt in Chylomikronen, VLDL, IDL, LDL, HDL und Lipoprotein a.
Cholesterin dient im Körper unter anderem als Vorstufe für Steroidhormone und Gallensäuren. Für die Bildung von Hormonen wandelt das Cholesterin-Seitenkettentrennungsenzym Cholesterin zu Pregnenolon um. Dieses ist die Ausgangsverbindung, aus der der Körper die Geschlechtshormone Testosteron, Östradiol und Progesteron und Nebennierenhormone (Corticoide) wie Cortisol und Aldosteron aufbaut. Auch Gallensäuren wie Cholsäure und Glykocholsäure basieren auf der Ausgangssubstanz Cholesterin.[6]
Ein Zwischenprodukt der Cholesterinbiosynthese, das 7-Dehydrocholesterin, ist das Provitamin zur Bildung von Vitamin D durch UV-Licht.
Neue Forschungen zeigen zudem, dass der Körper Cholesterin zur Biosynthese herzwirksamer Glykoside nutzt. Welche Bedeutung diese endogen synthetisierten Glykoside haben, ist noch weitgehend unbekannt.
Aufgrund von Sedimentfunden mit chemischen Cholesterin-Verwandten (Sterolen) wird von einigen Forschern angenommen, dass das Cholesterinmolekül, sofern es nie anders als in belebter Materie auftrat, evolutionsgeschichtlich sehr alt sein müsse.[7] Die Biosynthese des Moleküls könne allerdings erst funktionieren, seitdem Sauerstoff in der Atmosphäre vorhanden sei. In Bakterien und den Membranen von Mitochondrien findet sich aus diesem Grund kaum Cholesterin; Pflanzen und Pilze enthalten ebenfalls kein Cholesterin, dafür aber andere, strukturell ähnliche Sterole.
Chemische Einordnung
Cholesterin ist ein polycyclischer Alkohol. Herkömmlich wird es als zur Gruppe der Sterine (Sterole) gehörendes Steroid zu den lipidähnlichen Substanzen gerechnet; entgegen einer verbreiteten Verwechslung ist es jedoch kein Fett. Die Steroide gehören zu den Isoprenoiden, die im Gegensatz zu den Fetten keine Ester aus Fettsäure und Alkohol sind, sondern hydrophile Pole als diverse Muster in ihrer hydrophoben Grundstruktur aufweisen können.
Cholesterin ist, wie viele Substanzen, sensibel gegenüber Oxidantien. Autoxidationsprozesse können zu vielen Reaktionsprodukten führen. Bisher sind bereits über achtzig solcher Substanzen bekannt, die häufig beachtliche physiologische Wirkungen haben. Die Isolierung und Reindarstellung der Oxidationsprodukte gelingt durch chromatographische Verfahren. Ihre sichere Identifizierung erfolgt z. B. durch spektroskopische oder spektrometrische Methoden wie der Massenspektrometrie.[8] Eine umfassende Darstellung dieser Cholesterinoxidationsprodukte gibt das Werk von Leland L. Smith: Cholesterol Autoxidation.[9]
Physiologie
Cholesterin ist ein für Menschen und Tiere lebenswichtiges Zoosterin. Beim Menschen wird Cholesterin zum Großteil (90 %) im Körper selbst hergestellt (synthetisiert), beim Erwachsenen in einer Menge von 1 bis 2 g pro Tag, und kann nur zu einem kleinen Teil mit der Nahrung aufgenommen werden. Die Cholesterinresorption liegt im Durchschnitt bei 0,1 bis 0,3 g pro Tag und kann höchstens auf 0,5 g pro Tag gesteigert werden.
Alle Tiere synthetisieren Cholesterin. Ausgehend von „aktivierter Essigsäure“, dem Acetyl-CoA, wird über Mevalonsäure in vier Schritten Isopentenyldiphosphat erzeugt. Weitere drei Reaktionsschritte führen zum Squalen. Nach dem Ringschluss zum Lanosterin folgen etwa ein Dutzend enzymatischer Reaktionen, die auch parallel verlaufen können, bis schließlich Cholesterin entstanden ist. Dieser letzte Abschnitt ist nicht in allen Einzelheiten bekannt, die beteiligten Enzyme sind jedoch identifiziert.[10]
Cholesterin wird über die Leber ausgeschieden, indem es in Form von Gallensäuren über die Gallenwege in den Darm sezerniert wird (etwa 500 mg pro Tag). Gallensäuren sind für die Resorption wasserunlöslicher Nahrungsbestandteile, also auch von Cholesterin, erforderlich. Cholesterin wird durch Gallensäuren emulgiert und im Dünndarm resorbiert. Da etwa 90 % der Gallensäuren wieder aufgenommen werden, ist die Ausscheidung von Cholesterin entsprechend ineffektiv. Durch Medikamente wie Colestyramin, die Gallensäuren binden und damit ihre Wiederaufnahme erschweren, kann die Cholesterinausscheidung gesteigert werden. Allerdings wird dann die Senkung des Cholesterinspiegels durch Zunahme der LDL-Rezeptordichte auf Leberzellen und die damit gesteigerte Cholesterinaufnahme aus dem Blut in die Leber, teilweise auch durch eine vermehrte Neusynthese, ausgeglichen.[11]
Biosynthese
Die Biosynthese des Cholesterins, die insbesondere durch Arbeiten von Konrad Bloch, Feodor Lynen, George Joseph Popják und John W. Cornforth aufgeklärt wurde, geht von den Endprodukten des Mevalonatbiosyntheseweges, von Dimethylallylpyrophosphat und von Isopentenylpyrophosphat aus und benötigt 13 weitere Reaktionen. Beim Menschen sind die Leber und die Darmschleimhaut die Hauptorte der Cholesterinsynthese.
Regulation
Das Gleichgewicht zwischen benötigtem, selbst produziertem und über die Nahrung aufgenommenem Cholesterin wird über vielfältige Mechanismen aufrechterhalten. Als wichtig kann dabei die Hemmung der HMG-CoA-Reduktase, des wichtigsten Enzyms der Cholesterinbiosynthese, durch Cholesterin gelten (noch stärker wird die HMG-CoA-Reduktase durch Lanosterol, eine Vorstufe von Cholesterin, gehemmt). Damit hemmen Produkte dieses Stoffwechselwegs (Cholesterinsynthese) „ihr“ Enzym; dies ist ein typisches Beispiel negativer Rückkopplung. Außerdem verkürzt sich die Halbwertszeit der HMG-CoA-Reduktase bei erhöhtem Lanosterolspiegel stark, da sie dann vermehrt an die Proteine Insig-1 und Insig-2 bindet, was schließlich zu ihrem Abbau im Proteasom führt.[12] Es gibt noch viele andere, weniger direkte Regulationsmechanismen, die auf transkriptioneller Ebene ablaufen. Hier sind die Proteine SCAP, Insig-1 und Insig-2 wichtig, die in Anwesenheit von Cholesterin, für das sie eine Bindungsstelle besitzen, über die proteolytische Aktivierung von SREBPs die Aktivität einer größeren Anzahl Gene regulieren. Auch Insulin spielt hier eine Rolle, da es u. a. die Transkription von SREBP1c steigert.
Die HMG-CoA-Reduktase, das Schlüsselenzym der Cholesterinbiosynthese, kann spezifisch und effektiv durch verschiedene Substanzen gehemmt werden (beispielsweise Statine, die als HMG-CoA-Reduktase-Hemmer eine bestimmte Klasse von Medikamenten darstellen). Über den LDL-Rezeptor wird die Aufnahme in die Zelle aktiviert.
Die Höhe des Cholesterinspiegels hängt vor allem von der körpereigenen Produktion ab und erst in zweiter Linie von der Zufuhr über die Nahrung. Daneben gibt es eine Vielzahl genetisch bedingter Hypercholesterinämien. Auch als Folge anderer Erkrankungen kann der Cholesterinspiegel erhöht sein (beispielsweise durch Hypothyreose, Niereninsuffizienz oder metabolisches Syndrom).
Cholesterintransport (Lipoproteine)
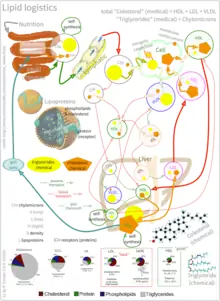
Da Cholesterin in Wasser unlöslich ist, erfolgt der Transport im Blutplasma zusammen mit anderen lipophilen Substanzen wie Phospholipiden, Triglyceriden oder Fettsäuren, mit Hilfe von Transportvesikeln, den Lipoproteinen.
Das über die Nahrung zugeführte Cholesterin sowie Triglyceride werden nach der Resorption aus dem Darm von den Chylomikronen aufgenommen und von dort in die Leber transportiert. Lipoproteine verschiedener Dichte (VLDL, IDL und LDL) transportieren selbst hergestelltes und aufgenommenes Cholesterin von der Leber zu den Geweben. HDL nehmen Cholesterin aus den Geweben auf und bringen es zur Leber zurück (reverser Cholesterintransport). Das Cholesterin in den Lipoproteinen ist überwiegend mit Fettsäuren verestert. Das Spektrum dieser Fettsäuren ist in starkem Maße durch die mit der Nahrung aufgenommenen Triglyceride zu beeinflussen. Dies zeigen insbesondere Studien an Bevölkerungsgruppen mit speziellen Ernährungsformen wie z. B. Vegetarier und Veganer.[13]
Für den Abbau des LDL-Cholesterins im Blut gibt es im menschlichen Körper zwei voneinander unabhängige Wege, den LDL-Rezeptorweg und den sogenannten Scavenger-Pathway. Der größte Teil, ca. 65 % des LDL-Cholesterins im Plasma, wird über LDL-Rezeptoren verstoffwechselt. LDL-Rezeptoren findet man in allen Zelltypen der Arterien und in Hepatozyten (Leberzellen). Neben dem LDL-Rezeptorweg werden circa 15 % des LDL-Cholesterins im Plasma über den Scavenger-Pathway in den Blutgefäßen abgebaut. Als Scavenger-Zellen werden die Makrophagen bezeichnet. Sie besitzen sogenannte Scavenger-Rezeptoren, über die chemisch modifizierte (oxidierte) LDL ungehemmt und konzentrationsunabhängig aufgenommen und gespeichert werden können.
Zusammenfassend lassen sich drei verschiedene Wege beschreiben, die das Cholesterin (unabhängig ob über die Nahrung oder selbst synthetisiert) im Organismus nimmt:
- Ausscheidung in die Galle und damit in einen enterohepatischen Kreislauf (Leber → Galle → Darm → Blut über die Vena portae → Leber).
- Umwandlung zu Gallensäuren, die an den Darm abgegeben werden.
- Abgabe ins Blut in Form von Lipoproteinen (VLDL → LDL → HDL) zur Synthese von Steroiden und Bildung von Membranen in anderen Organen.
Blutspiegel
Der durchschnittliche Gesamtcholesterinspiegel wie auch die LDL- und HDL-Spiegel der gesunden Normalbevölkerung sind von Land zu Land verschieden und darüber hinaus alters- und geschlechtsabhängig. Es besteht eine positive Korrelation zwischen den Blutcholesterin-Werten und dem Body-Mass-Index.[14]
Gesamtcholesterinspiegel
Generell nimmt der Gesamtcholesterinspiegel mit dem Alter deutlich zu. In der Regel ist er bei jungen Frauen etwas niedriger als bei jungen Männern. Mit zunehmendem Alter gleicht sich dieser Unterschied jedoch aus, und ältere Frauen haben schließlich im Mittel einen höheren Cholesterinspiegel als ältere Männer. Einen Sonderfall stellt die Schwangerschaft dar, in der der Gesamtcholesterinspiegel im Normalfall deutlich erhöht ist.
Der durchschnittliche Gesamtcholesterinspiegel der Altersgruppe zwischen 35 und 65 Jahren in Deutschland liegt bei etwa 236 mg/dl (entspricht 6,1 mmol/l), die Standardabweichung bei ±46 mg/dl. Das bedeutet näherungsweise, dass etwa zwei Drittel der deutschen Bevölkerung in dieser Altersgruppe einen Gesamtcholesterinwert im Bereich zwischen 190 mg/dl und 282 mg/dl aufweisen und je ein Sechstel der Deutschen in dieser Altersgruppe Werte oberhalb beziehungsweise unterhalb dieses Bereichs. In manchen Teilen Chinas liegt der durchschnittliche Cholesterinwert bei 94 mg/dl mit Normwerten zwischen 70 mg/dl und 170 mg/dl,[15] wobei die geringeren Cholesterinwerte mit einer geringeren Wahrscheinlichkeit an Herz- und Krebserkrankungen korrelieren.[15]
Im globalen Vergleich der Regionen sind die Serum-Cholesterinwerte in Nordamerika, Australien und in den meisten Teilen Europas in den letzten 40 Jahren (Stand 2017) leicht gesunken (um ca. 4 %). Diese Regionen haben allerdings weiterhin die höchsten mittleren Cholesterinwerte. Gleichzeitig sind in diesem Zeitraum die Werte in Ostasien, Südostasien und Südasien stetig gestiegen. 2008 gab es die niedrigsten Werte in Afrika südlich der Sahara. Nach Schätzungen auf der Grundlage von epidemiologischen Daten und Modellrechnungen sind erhöhte Cholesterinspiegel die Ursache für etwa 4,4 Millionen weltweite jährliche Todesfälle, und eine Reduktion des Spiegels um 1-mmol/l für 5 Jahre bei Personen mittleren Alters bedeute ein um ca. 20 % verringertes Risiko für eine Herzerkrankung.[16][17]
LDL-Cholesterinspiegel
Der LDL-Cholesterinspiegel unterliegt einer ähnlichen alters- und geschlechtsabhängigen Verteilung. Auch hier ist der altersabhängige Anstieg bei den Frauen deutlich stärker ausgeprägt als bei den Männern. Der Mittelwert der Altersgruppe zwischen 35 und 65 Jahren liegt dabei bei den deutschen Frauen bei 164 mg/dl (Standardabweichung ±44 mg/dl), bei den Männern bei 168 mg/dl (±43 mg/dl).
HDL-Cholesterinspiegel
Der durchschnittliche HDL-Spiegel unterscheidet sich stärker zwischen den beiden Geschlechtern, wobei Frauen im mittleren Alter einen höheren HDL-Spiegel aufweisen als Männer. Die Altersabhängigkeit zeigt sich hier bei beiden Geschlechtern in einem Absinken ab einem Alter von etwa 55 Jahren. Der durchschnittliche HDL-Spiegel bei den deutschen Frauen in der Altersgruppe zwischen 35 und 65 Jahren liegt bei 45 mg/dl (±12 mg/dl), bei den Männern bei 37 mg/dl (±11 mg/dl).
Quotienten
Auf Grundlage der vorgenannten Parameter werden gelegentlich Quotienten aus diesen Werten bestimmt. Der Mittelwert des Quotienten aus LDL- und HDL-Spiegel liegt für die deutschen Frauen zwischen 35 und 65 Jahren bei 3,9 (±1,6), bei den Männern bei 4,9 (±1,9). Die entsprechenden Durchschnittswerte für den Quotienten aus dem Gesamtcholesterin- und dem HDL-Spiegel liegen für die Frauen bei 5,7 (±2,1), für die Männer bei 7,0 (±2,3).
Messung und Labor-Referenzwerte
Die Bestimmung der Konzentration von Cholesterin im Blut in medizinischen Routinelabors gehört heute zu den Bestimmungsmethoden, die in Deutschland ringversuchspflichtig sind. Ein Ringversuch ist die externe Qualitätskontrolle von Laborparametern, die von der Bundesärztekammer kontrolliert und zertifiziert wird. An die „Richtlinien der Bundesärztekammer“ (RiLiBÄK) muss sich jedes medizinische Labor in Deutschland halten. Der Referenzbereich (oftmals irreführend als „Normalwert“ bezeichnet) ist vom Messgerät und der Methode abhängig. Die Referenzbereiche wurden in den letzten Jahren mehrfach nach oben korrigiert. Um eine Verfälschung der Ergebnisse auszuschließen, wird die Bestimmung häufig erst 12 bis 16 Stunden nach der letzten Mahlzeit durchgeführt.
Lange Zeit wurde im Labor nur das Gesamtcholesterin bestimmt, da die direkte Messung der verschiedenen Lipoproteine nicht möglich bzw. sehr aufwendig war. Das hat sich mittlerweile geändert. Das LDL-Cholesterin wurde ursprünglich nicht direkt gemessen, sondern aus den direkt gemessenen Werten für Gesamtcholesterin, Triglyceride und HDL nach Friedewald et al.[18] abgeschätzt. Diese Methode kann nicht angewendet werden für Triglyzeridwerte über 400 mg/dl oder bei Vorliegen einer Chylomikronämie. Verschiedene Korrekturfaktoren sind vorgeschlagen worden, um die Präzision dieser Abschätzung zu erhöhen, jedoch sind sie bisher nicht in die klinische Praxis eingegangen. Heute wird diese Methode nur noch selten angewandt, stattdessen in Routinelaboratorien mit Analysatoren der klinischen Chemie direkt gemessen.
Der Referenzbereich für den LDL-Cholesterinspiegel wird für Frauen und Männer zwischen 70 und 180 mg/dl angegeben.
Zur zuverlässigen Bestimmung des Cholesterins können nach adäquater Probenvorbereitung auch die Kopplungen von Gaschromatographie und HPLC mit der Massenspektrometrie eingesetzt werden.[19][20]
Einheiten und Umrechnung
In Westdeutschland wird für die Angabe der Konzentration von Cholesterin im Blut häufig die Einheit „mg/dl“ (Milligramm pro Deziliter) verwendet. In Ostdeutschland wird dagegen – wie im angelsächsischen Sprachraum – überwiegend die Einheit „mmol/l“ (Millimol pro Liter, vergleiche Milli und Mol) benutzt. Für Cholesterin (nicht jedoch für Triglyceride oder andere Stoffe) gilt der folgende Zusammenhang zwischen diesen Maßeinheiten:
- 1 mg/dl = 0,02586 mmol/l
- 1 mmol/l = 38,67 mg/dl
Beispiel:
- 236 mg/dl = 236 · 0,02586 mmol/l = 6,10 mmol/l
- 6,10 mmol/l = 6,10 · 38,67 mg/dl = 236 mg/dl
Für Triglyceride gelten die folgenden Umrechnungsformeln:
- 1 mg/dl = 0,0113 mmol/l
- 1 mmol/l = 88,57 mg/dl
Erkrankungen
Zu den bekannten Erkrankungen im Zusammenhang mit Cholesterin gehören die familiäre Hypercholesterinämie und Gallensteine (Gallenkonkrement).
Familiäre Hypercholesterinämie
Es gibt erbliche Störungen des Cholesterinstoffwechsels (familiäre Hypercholesterinämie), die unabhängig von der Nahrungsaufnahme zu stark erhöhten Cholesterinwerten im Blut führen. Bei einer der bekannten Formen der Hypercholesterinämie sind die LDL-Rezeptoren nur unvollständig ausgebildet oder fehlen ganz.
Heterozygote Träger dieser Erbfaktoren sind überdurchschnittlich häufig schon in jüngeren Jahren von Herzinfarkten und anderen Gefäßkrankheiten betroffen. Gemäß einer Untersuchung aus dem Jahre 1991 gilt dies nicht mehr für ältere Personen. Hier geht die Mortalität sogar deutlich zurück und liegt nur bei 44 % gegenüber dem Standard.[21]
Die Prävalenz der häufigsten monogenetischen Hypercholesterinämie, der sogenannten autosomal dominanten familiären Hypercholesterinämie, liegt bei ca. 1:250.[22] Bei schwereren Ausprägungen der Hypercholesterinämie (wie der familiären Hypercholesterinämie) werden medikamentöse Therapien mit Statinen, die LDL-Apherese und teilweise auch chirurgische Therapieformen eingesetzt.[23]
Gallensteine
Cholesterin wird mit der Gallensäure im Darm vom Körper aufgenommen. Dabei wird Cholesterin emulgiert und im Dünndarm resorbiert. Die Löslichkeit von Cholesterin in der Gesamtgalle liegt bei 0,26 %. Bei einer Veränderung der Zusammensetzung der Galle kommt es zur Bildung von Cholesterinsteinen. 80 % der Gallensteine sind cholesterinreich und 50 % reine Cholesterinsteine. Die Bildung von Gallensteinen erfolgt nicht nur in der Gallenblase, sondern auch in der Leber.
Weitere Krankheitsformen
Weniger bekannte Erkrankungen sind zum Beispiel die Cholesterinspeicherkrankheit (Xanthomatose oder Hand-Schüller-Christian-Syndrom), bei der Cholesterin krankhaft unter anderem in der Haut gespeichert wird.
Mit einer Häufigkeit von ca. 1:60.000 kommt in Europa das Smith-Lemli-Opitz-Syndrom (SLO) vor. Grund für die Erkrankung mit SLO-Syndrom ist ein Defekt des letzten Enzyms des Cholesterin-Biosynthesewegs, der 7-Dehydrocholesterin-Reduktase. Das klinische Bild ist gekennzeichnet durch geistige Retardierung, Wachstumsprobleme, Entwicklungsstörungen und Gesichtsveränderungen.
Weiterhin ist eine Hypocholesterinämie bekannt, bei der der Cholesterinspiegel unter 130 mg/dl im Blut vorliegt. Dies tritt vor allem bei Leberschädigung wie einer Leberzirrhose,[24] der genetisch bedingten Tangier-Krankheit[25] und bei Manganmangel[26] auf. Dabei kann unter anderem das Vitamin E nicht mehr an seine entsprechenden Zielorte transportiert werden.
Cholesterin und die koronare Herzkrankheit (KHK)
Herz-Kreislauf-Erkrankungen, dabei insbesondere die koronare Herzkrankheit (KHK), lösten mit steigendem Lebensstandard im 20. Jahrhundert in den westlichen Industrienationen die Infektionskrankheiten als häufigste Todesursache ab.
Die Cholesterin-Hypothese
In den 1950er-Jahren fand die Hypothese des amerikanischen Ernährungsforschers Ancel Keys große Beachtung, diese Entwicklung sei zusätzlich dadurch begünstigt, dass der steigende Wohlstand mit einer zu fetthaltigen Ernährung einhergehe. Insbesondere führe eine cholesterinreiche Ernährung (in erster Linie Fleisch, Hühnerei, Milch, Butter und andere Milchprodukte) zu einem erhöhten Cholesterinspiegel. Die Aufnahme von cholesterinhaltiger Nahrung sei somit eine von vielen Ursachen für einen Herzinfarkt. Keys selbst relativierte die Bedeutung der ernährungsbedingten Cholesterinaufnahme für den Cholesterinspiegel im menschlichen Blut bereits 1965: „Um den Serumspiegel zu kontrollieren, sollte das diätetische Cholesterin nicht vollständig ignoriert werden, aber die Beachtung dieses Faktors allein bringt wenig.“[27]
Die Cholesterin-Hypothese stützt sich ausschließlich auf empirisch gewonnene Hinweise. Es konnte jedoch bisher kein biologischer Mechanismus nachgewiesen werden, der über das Cholesterin bzw. einen erhöhten Cholesterinspiegel zur Plaquebildung führt.
Die Hypothese, cholesterinreiche Ernährung und ein hoher Blut-Cholesterinspiegel spielten eine ursächliche Rolle bei der Entstehung von Herzinfarkten, hat in den vergangenen Jahrzehnten im wissenschaftlichen Umfeld wie in der öffentlichen Wahrnehmung große Verbreitung gefunden. Sie bildete in der medizinischen Praxis ein wesentliches Element der Vorbeugung von Herzinfarkten und führte insbesondere in den USA, aber auch in Europa zur Verbreitung künstlich cholesterinreduzierter oder cholesterinfreier Lebensmittel (beispielsweise Margarine) sowie zu einer routinemäßigen Verschreibung von Medikamenten zur Senkung des Cholesterinspiegels.
Heute besteht ein wissenschaftlicher Konsens über den Zusammenhang des Cholesterinspiegels im Gefäßsystem und arteriosklerotischer kardiovaskulärer Erkrankungen.[28]
Cholesterin im Körper
- Cholesterin ist ein wesentlicher Bestandteil der arteriosklerotischen Plaques. Dies wurde 1910 vom deutschen Chemiker und späteren Nobelpreisträger Adolf Windaus nachgewiesen.
- Bei jüngeren Männern bis zum Alter von etwa 45 Jahren geht ein hoher Gesamt- bzw. LDL-Cholesterinspiegel mit einem erhöhten Auftreten von koronaren Herzerkrankungen (KHK) einher und stellt dabei neben den weiteren bekannten Risikofaktoren einen eigenständigen Risikofaktor dar. Das bedeutet, dass sich diese Korrelation nicht allein durch die Korrelation des Cholesterinspiegels mit anderen bekannten KHK-Risikofaktoren erklären lässt. Weitere bekannte Risikofaktoren sind Lebensalter, Geschlecht, positive Familienanamnese (d. h. Auftreten von Herzinfarkt in der näheren Verwandtschaft), Rauchen, Diabetes mellitus, Bluthochdruck, Übergewicht und Bewegungsmangel. Für jüngere wie ältere Frauen und für ältere Männer stellt ein hoher Cholesterinspiegel allerdings – entgegen der weit verbreiteten Meinung – keinen Risikofaktor für Koronare Herzerkrankungen dar.
- Patienten mit familiärer Hypercholesterinämie haben aufgrund eines erblichen Gendefekts einen sehr hohen Cholesterinspiegel (oft 400 mg/dl und mehr) und in jungen Jahren ein gegenüber der Normalbevölkerung um ein Vielfaches gesteigertes KHK-Risiko. Durch die Vergabe verschiedener Lipidsenker konnte die Lebenserwartung dieser Patienten erhöht werden. Das KHK-Risiko dieser Patienten normalisiert sich allerdings in einem Alter ab etwa 55 Jahren.[29]
- In zahlreichen Studien wurde demonstriert, dass die Einnahme von Medikamenten zur Cholesterinsenkung insbesondere bei männlichen KHK-Hochrisikopatienten zu einem Rückgang des Herzinfarktrisikos führen kann, der allerdings in aller Regel durch eine Zunahme anderer Todesursachen kompensiert wurde. In den vergangenen Jahren konnte mit der Medikamentengruppe der Statine in einzelnen Studien erstmals auch ein geringer lebensverlängernder Nutzen der Einnahme eines Cholesterinsenkungspräparats demonstriert werden. Dieser zeigte sich allerdings nur in einem Teil der durchgeführten Studien und nur bei männlichen KHK-Hochrisikopatienten mittleren Alters.
- Menschen mit einer bestimmten Variante in dem Gen für den Low-Density-Lipoprotein-Rezeptor (LDL-Rezeptor) haben ein Leben lang niedrigere Cholesterinspiegel im Blut. Das Herzinfarktrisiko ist bei diesen Menschen um 23 % vermindert. Der LDL-Rezeptor bindet allerdings nicht nur LDL, sondern auch mehrere andere Proteine, sodass der Zusammenhang durch diesen Fakt noch nicht hergestellt ist.[30]
Die European Atherosclerosis Society schreibt:
„Unabhängige Meta-Analysen von über 200 prospektiven Kohortenstudien, mendelsch-randomisierten und randomisierten Studien, mit über 2 Millionen Teilnehmern bei 20 Millionen Jahren Follow-up und 150.000 kardiovaskulären Ereignissen zeigen eine überwältigend eindeutige, dosis-abhängige logarithmisch-lineare Korrelation zwischen der absoluten Höhe der vaskulären Exposition gegenüber LDL-C und dem Risiko einer arteriosklerotischen kardiovaskulären Erkrankung; dieser Effekt scheint sich zu erhöhen, je länger die Exposition zu LDL-C ist. Sowohl natürlich randomisierte genetische Studien als auch die randomisierten Interventionsstudien zeigen konsistent, dass jeder Mechanismus, der die Plasmakonzentration von LDL senkt, auch das Risiko eines arteriosklerotischen kardiovaskulären Ereignisses senken sollte, proportional zur absoluten LDL-C-Reduktion und zur zeitlich kumulativen Exposition gegenüber LDL-C, wenn die erreichte LDL-C-Reduktion zusammenfällt mit der Reduktion der LDL-Partikelzahl und es keine gegenspielenden Off-Target-Effekte gibt.“[31]
High-Density-Lipoprotein versus Low-Density-Lipoprotein
Die ursprüngliche Hypothese, ein erhöhter Cholesterinspiegel sei kausal verantwortlich für die koronare Herzerkrankung, wird in jüngerer Zeit meist nur noch in modifizierter Form vertreten. Unterschieden wird nun zwischen HDL- und LDL-Cholesterin, wobei ein hoher HDL-Cholesterinspiegel als günstig, ein hoher LDL-Spiegel dagegen als weniger günstig angesehen wird. Entsprechend dieser Vorstellung wird HDL populärwissenschaftlich als „gutes“ Cholesterin bezeichnet, LDL als „schlechtes“ Cholesterin.
Diese Vorstellung stützt sich auf verschiedene Beobachtungen:
- HDL fördert den Transport von Cholesterin vom Gewebe zur Leber, während LDL zum Transport in umgekehrter Richtung beiträgt. Aufgrund dessen wird vermutet, dass ein hoher HDL-Spiegel und ein niedriger LDL-Spiegel dazu führen, dass im Verhältnis mehr Cholesterin von den Gefäßen zur Leber transportiert wird und sich deshalb weniger arteriosklerotische Plaques bilden können.
- Das Verhältnis von LDL zu HDL korreliert noch stärker als der Gesamtcholesterinspiegel mit den bekannten Risikofaktoren für Arteriosklerose, wie Alter, Geschlecht, Rauchen, Übergewicht und Bewegungsmangel. Betrachtet man also lediglich die HDL- und LDL-Spiegel, ohne eine Normierung bezüglich der Risikofaktoren vorzunehmen, so scheint das Risiko sehr deutlich mit dem LDL-Spiegel zu steigen.
- In wissenschaftlichen Untersuchungen der letzten 20–30 Jahre hat man festgestellt, dass die arteriosklerotischen Plaques überwiegend aus chemisch modifiziertem (oxidiertem) LDL-Cholesterin entstehen (siehe den Abschnitt Die Lipoprotein-induced-atherosclerosis-Hypothese im Artikel Arteriosklerose).
Cholesterin in der Nahrung
- Bei Hasen und anderen überwiegend vegetarisch lebenden Tieren führt im Tierversuch die Verabreichung einer stark cholesterinhaltigen Nahrung (Milch, Eigelb) zur Entwicklung einer Arteriosklerose. Diese Beobachtung wurde erstmals 1908 von dem russischen Wissenschaftler Alexander Ignatowski veröffentlicht. Umstritten ist allerdings die Übertragbarkeit dieser Ergebnisse auf den Menschen, da dessen natürlicher Regelmechanismus für die Höhe des Cholesterinspiegels die Aufnahme von Cholesterin über die Nahrung nahezu vollständig kompensiert. Daher wurden später ähnliche Untersuchungen an Schweinen vorgenommen, welche eine 70%ige Homologie zum Menschen aufweisen, ferner auch an Affen, mit ähnlichen Ergebnissen wie bei den Hasen. Bei einzelnen der untersuchten Affenarten, die wie Schweine oft Allesfresser mit überwiegend vegetarischer Ernährung sind, fand man allerdings starke individuelle Unterschiede auch innerhalb einer Art. Bei einzelnen Individuen lässt sich der Cholesterinspiegel demnach durch die Ernährung beeinflussen („hyper-responders“), bei anderen nicht („hypo-responders“).
- Ancel Keys veröffentlichte aufsehenerregende vergleichende Studien von sechs (1953[32]) bzw. sieben Ländern (1966, 1970 und 1980[32]), in denen er für diese Länder länderübergreifend eine Korrelation zwischen der Rate koronarer Herzkrankheiten (KHK; Erkrankung der Herzkranzgefäße) und dem Anteil tierischer Fette in der Ernährung zeigte. Insbesondere Japan wies eine niedrige KHK-Rate auf, bei gleichzeitig geringem Anteil tierischer Fette in der Nahrung, in den USA ist das Gegenteil der Fall. Später wurde Keys zum Vorwurf gemacht, dass er gezielt nur diejenigen der zu diesem Zeitpunkt veröffentlichten Länder-Datensätze präsentiert habe, die die von ihm postulierte Korrelation unterstützten. Andere Studien, welche die KHK-Rate von eingewanderten Japanern in den USA untersuchten, konstatierten eine Angleichung der niedrigeren japanischen an die USA-KHK-Rate. Dies könnte für ernährungsbedingte Faktoren sprechen, wäre aber auch durch andere Faktoren erklärbar, die mit dem Lebensstil zusammenhängen. Kritiker stellen auch die Vergleichbarkeit der von verschiedenen Staaten veröffentlichten Todesursachen in Frage, da bei der Feststellung der Todesursache auch lokale Gewohnheiten und kulturelle Faktoren eine Rolle spielten.
Empfehlungen zu Lebensstil und medikamentöser Behandlung
Die Hypothese, Cholesterin sei kausal verantwortlich für Herzinfarkte, führte bereits in den 1960er Jahren zu einer breit angelegten öffentlichen Informationskampagne in den USA, um die Bevölkerung vor den möglichen Gefahren eines hohen Cholesterinspiegels zu warnen. Im Jahre 1984 warnte das amerikanische Nachrichtenmagazin Time in einer Titelgeschichte vor dem Verzehr von Eiern und Wurst. Im Jahre 1985 wurde zur Ausweitung dieser Kampagne durch die American Heart Association (AHA, Amerikanischer Kardiologenverband) das National Cholesterol Education Program (NCEP, Nationales Cholesterin-Erziehungsprogramm) ins Leben gerufen. Das NCEP gibt seit seiner Gründung regelmäßig Empfehlungen heraus, an denen sich die Behandlung von Patienten mit hohem Cholesterinspiegel orientieren soll. In Deutschland ist die Deutsche Gesellschaft für Kardiologie (DGK) die entsprechende Fachgesellschaft, die eigene Zielwerte herausgibt, die aber in der Regel den amerikanischen Werten sehr ähnlich sind. Eine vergleichbare Rolle wie das NCEP übernimmt in Deutschland die industrienahe Lipid-Liga.
Die grundlegenden Richtlinien der NCEP III, denen sich die europäischen und deutschen Gesellschaften angeschlossen haben, unterscheiden drei gestaffelte Risikogruppen. Zur Gruppe 1 zählen alle Patienten, die bereits eine KHK entwickelt haben oder ein vergleichbares Risiko aufweisen (dazu zählt z. B. auch eine Diabeteserkrankung). Diese Patienten haben ein 10-Jahres-Risiko für ein kardiales Ereignis von >20 %. Zur Gruppe 2 zählen die Patienten, die mindestens zwei Risikofaktoren aufweisen, zur Gruppe 3 die Patienten, die weniger als zwei Risikofaktoren aufweisen.[33]
Patienten der Gruppe 1 sollten bei LDL-Werten über 100 mg/dl Lebensstiländerungen vornehmen (Ernährung etc.), bei Werten über 130 mg/dl eine medikamentöse Therapie beginnen. Ziel sollte für sie sein, LDL-Werte unter 100 mg/dl zu erreichen.
Patienten der Gruppe 2 sollten bei LDL-Werten über 130 mg/dl Lebensstiländerungen vornehmen, bei Werten über 130 mg/dl oder 160 mg/dl (abhängig von der spezifischen Risikoberechnung) eine medikamentöse Therapie beginnen. Ziel sollte sein, LDL-Werte unter 130 mg/dl zu erreichen.
Patienten der Gruppe 3 sollten bei LDL-Werten über 160 mg/dl eine Lebensstiländerung vornehmen und eine medikamentöse Therapie erwägen, ab 190 mg/dl wird eine medikamentöse Therapie dringend empfohlen.
Als Risikofaktoren gelten:
- Rauchen
- erhöhter Blutdruck (über 140/90 mmHg oder eine aktuelle hypertensive Behandlung)
- niedriges HDL-Cholesterin (<40 mg/dl)
- koronare Herzerkrankungen in der Familie (bei männlichen Verwandten ersten Grades unter 55 Jahren oder weiblichen Verwandten ersten Grades unter 65 Jahren)
- Alter (Männer über 45, Frauen über 55 Jahre)
Als Lebensstiländerungen werden empfohlen:
- Reduktion der verzehrten gesättigten Fettsäuren (<7 % der Gesamtenergie) und des Cholesterins
- nichtmedikamentöse Therapieoptionen zur LDL-Senkung (z. B. pflanzliche Sterole (2 g/Tag) etc.)
- Gewichtsreduktion
- erhöhte körperliche Betätigung
Die Anwendung dieser Zielwerte wird von den deutschen Fachgesellschaften der Kardiologen und Internisten unterstützt und befürwortet.[34]
Cholesterin und Schlaganfallrisiko
Der Zusammenhang von Cholesterin und Schlaganfällen ist komplex, zumal Cholesterin nicht der einzige Risikofaktor für Schlaganfälle ist, sondern auch der Blutdruck einen starken Einfluss hat. Generell hat sich in den letzten Jahren jedoch gezeigt, dass hohe Cholesterinspiegel ein höheres Risiko für ischämische arteriothrombotische Schlaganfälle bedeuten, also Schlaganfälle, die durch einen Gefäßverschluss auf dem Boden einer Arteriosklerose entstehen. Gleichzeitig schützen höhere Cholesterinspiegel aber vor Schlaganfällen durch Hirnblutungen (hämorrhagischer Schlaganfall). Umgekehrt bedeuten niedrige Cholesterinspiegel ein höheres Risiko für hämorrhagische Schlaganfälle. Der Zusammenhang wurde in vielen unterschiedlichen Studien gefunden, sodass mit Stand 2019 davon ausgegangen werden kann, dass Cholesterin „wahrscheinlich“ eine ursächliche Rolle spielt. Für die Therapie bedeutet das, dass eine cholesterinsenkende Therapie beispielsweise mit Statinen das Risiko für ischämische Schlaganfälle senkt. Es muss allerdings auch auf eine gute Blutdruckeinstellung geachtet werden, da hoher Blutdruck das Risiko für alle Schlaganfallarten steigert. Niedrige Cholesterinspiegel bei hohem Blutdruck bedeuten ein noch höheres Risiko für hämorrhagische Schlaganfälle.[35]
Cholesterin und Krebserkrankungen
Cholesterin spielt beim Metabolismus verschiedener Krebsarten eine wesentliche Rolle. Cholesterin-Derivate begünstigen das Krebswachstum und unterdrücken die Immunabwehr des Körpers.[36]
Serum-Cholesterinspiegel und Krebsrisiko
Bei Krebserkrankung ist der Cholesterinspiegel zum Beispiel bei an Brustkrebs erkrankten Frauen im Vergleich zu Gesunden erhöht.[37][38] Ursache dafür könnte sein, dass ein Abbauprodukt von Cholesterin, das Oxysterol, dem Östrogen sehr ähnlich ist und auch eine wachstumsfördernde Wirkung hat.[39]
Bei fortschreitendem Leberkrebs wird die Cholesterinbildung eingeschränkt und als Folge sinkt auch der Serum-Cholesterinspiegel.
Eine cholesterin- und fettreiche Ernährung beeinflusst das Krebswachstum.[40]
Cholesterin und geistige Gesundheit
Cholesterin und Gewaltbereitschaft
In einer im Jahre 2005 veröffentlichten Studie zeigte sich ein statistisch signifikanter Zusammenhang zwischen einem niedrigen Gesamtcholesterinspiegel bei Kindern und Schulverweisen. Kinder und Jugendliche mit einem Gesamtcholesterinspiegel unterhalb des -Perzentils (<145 mg/dl) hatten eine fast dreifach erhöhte Wahrscheinlichkeit, in ihrer Schullaufbahn von der Schule verwiesen worden zu sein. Dies wird von den Autoren als weiterer Hinweis dafür gewertet, dass niedrige Cholesterinspiegel mit einer erhöhten Aggressivität im Zusammenhang stehen.[41]
Cholesterin und Depressionen
Die Studienlage zum Zusammenhang von Depression und Cholesterinspiegel ist uneinheitlich.
Es gibt Studien, welche Depression mit niedrigen Spiegeln in Verbindung bringen,[42] und Studien, die erhöhte Spiegel bei Depression feststellten.[43][44]
Cholesterinspiegelerhöhung durch Stress
In einer Studie aus dem Jahr 2005 wurde ein Zusammenhang zwischen erhöhtem psychischem Stress und einer Erhöhung des Cholesterinspiegels nachgewiesen.[45] Dieser Zusammenhang zeigte sich sowohl kurzfristig als auch innerhalb eines Zeitraums von drei Jahren. Allerdings war die Ausprägung dieses Phänomens für verschiedene Probanden stark unterschiedlich. Die Probanden, die auch kurzfristig unter Stresseinfluss einen relativ hohen Cholesterinanstieg zeigten, hatten auch besonders hohe Anstiege über den längeren Zeitraum.
Gedächtnisleistung
In einer an 326 Frauen mittleren Alters durchgeführten und 2003 veröffentlichten Studie zeigte sich eine lineare Korrelation der Gedächtnisleistung mit dem LDL-Cholesterinspiegel. 29 Frauen nahmen Lipidsenker.[46]
In einer anderen Studie wurden 3.486 Männer und 1.341 Frauen mit einem mittleren Alter von 55 Jahren untersucht. Die Teilnehmer unterzogen sich drei kognitiven Tests über einen Zeitraum von 10 Jahren. Die Studie zeigte, dass hohe Cholesterinwerte zusammen mit Bluthochdruck zu frühem Gedächtnisverlust führten.[47]
Allgemein gelten heute hohe Cholesterinwerte zur Lebensmitte als Risiko für die Entwicklung von Demenz.[48] Ab einem Alter von 85 Jahren allerdings stehen hohe Cholesterinwerte in Zusammenhang mit besserer Gedächtnisleistung.[49]
Cholesterin und Ernährung

Einfluss der Ernährung auf den Cholesterinspiegel
Der Konsum von gesättigten Fetten (bspw. aus tierischen Lebensmitteln) und Transfetten (aus Fertigprodukten) regt in der Leber die Produktion von LDL-Cholesterin an und erhöht so den Spiegel.[52]
Eine Reduktion von gesättigten Fetten senkt somit das LDL-Cholesterin und damit das Risiko für koronare Herzkrankheit. Deshalb empfiehlt die Deutsche Gesellschaft für Ernährung, die Zufuhr von gesättigten Fettsäuren auf 7 % bis 10 % der Gesamtenergiezufuhr zu beschränken und die Zufuhr von mehrfach ungesättigten Fettsäuren zu steigern.[53]
Die Zufuhr von Nahrungscholesterin — hauptsächlich in tierischen Lebensmitteln enthalten[54] — führt mit wahrscheinlicher Evidenz zu einem Anstieg des Verhältnisses von Gesamt- zu HDL-Cholesterin und mit überzeugender Evidenz zu einem geringen Anstieg von Gesamt- und LDL-Cholesterin.[55]
Die National Academies of Sciences, Engineering, and Medicine empfehlen, die trans-Fettsäuren- und Cholesterinaufnahme „so niedrig wie möglich“ zu halten, ohne dabei die adäquate Nährstoffversorgung zu gefährden.[56]
Die meisten tierischen Lebensmittel enthalten sowohl Cholesterin als auch gesättigte Fette. In jüngerer Zeit wird argumentiert, dass die wenigen tierischen Lebensmitteln, die zwar viel Cholesterin, allerdings wenig gesättigte Fette enthalten (Eier, Shrimps), keinen negativen Einfluss auf die Herzkreislaufgesundheit haben.[57] So lässt der Konsum von Eiern für geschätzt 70 % der Menschen den Cholesterinspiegel kaum ansteigen. Bei Personen, bei denen Eierkonsum zu einem Anstieg des Gesamtcholesterinspiegels führt, steigt sowohl der LDL- als auch der HDL-Spiegel, was erklären könnte, warum Eier bislang in Beobachtungsstudien nicht eindeutig mit einem erhöhten Risiko für Herzkreislauferkrankungen assoziiert sind.[58] Um die gesundheitlichen Aspekte des Eierkonsums abschließend zu bewerten, sieht die Deutsche Gesellschaft für Ernährung noch Forschungsbedarf in Form von Interventionsstudien.[55]
Empfehlung bei hohem Cholesterinspiegel
Nach einer Diagnose eines hohen Cholesterinspiegels wird in der Regel als erste Maßnahme eine fettmodifizierte und cholesterinarme Ernährung empfohlen. Eine umfassende Darstellung zu dieser Frage wurde 1981 vom Institut für Sozialmedizin und Epidemiologie des Bundesgesundheitsamts veröffentlicht.[59]
Gemäß den Empfehlungen der DGFF (Lipid-Liga) sollten hierbei folgende Punkte bei der Nahrungsaufnahme bedacht werden:[60]
- Wenig fettes Fleisch, Innereien, Wurstwaren, Schinken
- Wenig Käse, Sahne, Vollmilch, Butter
- Eier nur maßvoll konsumieren
- Fettarme Zubereitung
- Wenig tierische Lebensmittel
- Mehrmals am Tag frisches Obst und Gemüse
- Verwendung von Pflanzenöl (jedoch kein Kokos oder gehärtete Margarine)
- Verzicht auf Alkohol
- Ausreichend Bewegung
Darüber hinaus wird ein Cholesterin-senkender Einfluss bestimmter Lebensmittel diskutiert. So können 3 g Beta-Glucan am Tag aus beta-glucanreichen Lebensmitteln wie Gerstenbackwaren, Gerstenflocken, Gersten-Salate oder Haferkleie als Teil einer abwechslungsreichen und ausgewogenen Ernährung den Cholesterinspiegel senken und reduzieren damit einen wesentlichen Risikofaktor von Herz- und Gefäßerkrankungen.[61] Diskutiert wird auch ein Einfluss der Ernährung auf die Cholesterinsynthese durch die Beeinflussung der Synthese von Prostaglandine.
Auch Vitamin-D-Supplemente können den Gesamt- und LDL-Cholesterinspiegel senken.[62]
Ungefilterter Kaffee enthält Öle, welche den Cholesterinspiegel ansteigen lassen können. Im Falle von Filterkaffee bleiben diese jedoch großteils im Filter zurück und wirken sich daher nicht aus.[63][64]
Pflanzenbasierte Ernährung
Nach einer Übersichtsarbeit von 2017 wurden bei Vegetariern und Veganern signifikant verringerte Gesamt- und LDL-Cholesterinspiegel beobachtet: bei Vegetariern −28,2 mg/dl bzw. −21,3 mg/dl und bei Veganern −31,0 mg/dl bzw. −22,9 mg/dl. Dies ging mit einem um 25 % verringerten Risiko für koronare Herzerkrankung einher.[65]
In Interventionsstudien wurde untersucht, ob eine Umstellung auf eine pflanzenbasierte Ernährung geringere Cholesterinspiegel mit sich bringt. Eine Meta-Analyse von 2015, die 11 Interventionsstudien einbezog, kam zu dem Schluss, dass LDL- und HDL-Spiegel bei pflanzenbasierter Ernährung signifikant verringert sind:
- Gesamtcholesterin −0,36 mmol/L (entspricht 13,9 mg/dl)
- LDL-Cholesterin −0,34 mmol/L (entspricht 13,1 mg/dl)
- HDL-Cholesterin −0,10 mmol/L (entspricht 3,9 mg/dl).[66]
Eine Meta-Analyse von 2017, die 30 Beobachtungs- und 19 Interventionsstudien einbezog, bestätigte diese Beobachtung und kam zu dem Schluss, dass vegane Kostformen den größten Effekt zeigen.[67]
Einfluss von Übergewicht
Bei Übergewicht treten Fettstoffwechselstörungen wie erhöhtes LDL-Cholesterin und hohe Plasma-Triglyzeride (→Hypertriglyceridämie) auf. Nach Gewichtsreduktion kann innerhalb kurzer Zeit eine Senkung des Gesamtcholesterins und des LDL-Cholesterins beobachtet werden. Im Vergleich zu anderen Lipiden am deutlichsten verringern sich die Triglyzeride unter einer Gewichtsreduktion. Es zeigte sich, dass eine Gewichtsreduktion von 7 bis 10 kg eine eindeutige Verbesserung in den Lipidparametern mit sich bringt. Zwischen dem HDL-Cholesterin und dem Körpergewicht besteht eine negative Korrelation. Bei einem Body-Mass-Index >30 werden unabhängig von Alter und Geschlecht des Betroffenen niedrigere Werte für das HDL-Cholesterin im Plasma gemessen. Beim Fasten oder einer Ernährung mit weniger als 1000 kcal pro Tag fällt der HDL-Cholesterinspiegel zunächst ab. Erst bei Gewichtskonstanz oder einem geringeren Energiedefizit steigt das HDL-Cholesterin an. Unter körperlichem Training bleibt es allerdings auch bei rascher Gewichtsreduktion konstant.[68] Durch eine langfristige Veränderung der Fettzusammensetzung – insbesondere den teilweisen Ersatz gesättigter durch ungesättigte Fette – kann bei Männern das Risiko für Herz-Kreislauf-Erkrankungen gesenkt werden. Allerdings ist ungeklärt, welches ungesättigte Fett der ideale Ersatz ist.[69]
Genetische Aspekte
Bei Gruppen wie den Massai, die sich fast ausschließlich von Milch und Fleisch ernähren, hat vermutlich genetische Selektion dazu geführt, dass diese niedrigere Cholesterinwerte aufweisen.[70]
Japaner, die in ihrer Heimat weniger von Arteriosklerose betroffen sind, hatten nach ihrer Migration in die USA höhere Cholesterinwerte und erkrankten doppelt so häufig an koronarer Herzkrankheit.[71]
Industriefinanzierte Studien
Neil Barnard et al. untersuchten den Einfluss der Eierproduzenten auf die Cholesterin-Forschung.[72] Barnard zufolge erhöhte sich die Zahl der industriefinanzierten Studien, die dem Einfluss der Ernährung auf den Cholesterinspiegel gewidmet waren, von 0 % in den 1950er Jahren auf 60 % im Zeitraum 2010 bis 2019. Unter den industriefinanzierten Interventionsstudien, die die Wirkung des Eikonsums auf die Cholesterinkonzentration bestimmten, zeigten 34 % einen signifikanten Effekt, von den nicht-industriefinanzierten Studien waren es 51 %. Die Autoren empfehlen Lesern, Redakteuren und der Öffentlichkeit, bei der Interpretation der Studienergebnisse und Schlussfolgerungen auf die Finanzierungsquellen zu achten.[73]
Mit Phytosterolen angereicherte Lebensmittel
Phytosterole aus Pflanzen können nachgewiesenermaßen die Aufnahme von Nahrungscholesterin senken. Einige Functional-Food- Lebensmittel sind daher mit ihnen in hohen Mengen angereichert, die über eine übliche Ernährung nicht erreicht werden. Allerdings hemmen Phytosterole bei dauerhafter Anwendung nicht nur die Cholesterolaufnahme, sondern auch die Aufnahme von Carotinoiden und fettlöslichen Vitaminen.[74] Zudem kann sich bei Menschen, die aufgrund genetischer Veränderungen überschüssige Phytosterole nicht abbauen können, dieses im Blut anreichern und Arteriosklerose hervorrufen. Damit erhöht sich für diese Personen sogar das Risiko einer Herz-Kreislauf-Erkrankung.[75][76]
Cholesterin-Skeptiker
Das THINCS (The International Network of Cholesterol Sceptics) ist ein loses Netzwerk von etwa 90 Wissenschaftlern, die die so genannte Cholesterinhypothese anzweifeln. Es wurde vom Dänen Uffe Ravnskov (* 1934) gegründet. Ihnen zufolge sei der Einfluss einer kurzfristigen Nahrungsumstellung auf den Cholesterinspiegel nur gering, da die Zusammensetzung der Nahrung nur einen geringen Anteil bei der Bildung von Cholesterin hat.[77]
Ravnskov argumentierte beispielsweise um 1999, eine genauere Auswertung von japanischen Einwanderern in die USA zeige, dass deren Herzerkrankungen und Arteriosklerose unabhängig von der Nahrungszusammensetzung und dem ermittelten Cholesterinspiegel sei. Vielmehr wirke sich ein Beibehalten des japanischen Lebensstils, unabhängig von der Ernährung, positiv aus: Japaner, die sich so fett ernährten wie Amerikaner, jedoch ansonsten weitgehend ihre traditionelle Lebensweise beibehielten, litten seltener an Arteriosklerose – sogar seltener als Japaner, die sich weiterhin fettarm/japanisch ernährten und sich aber an den amerikanischen Lebensstil gewöhnt hatten.[78]
Ravnskov wiederum wird von seinen Kollegen vorgeworfen, dass dieser die große Zahl gut designter Studien ignoriere, welche einen klaren Zusammenhang zwischen LDL-Cholesterin und Arteriosklerose zeigten.[79] Ravnskov konnte zwar in Briefen an die Herausgeber medizinischer Fachzeitschriften lange Jahre hin den Zusammenhang zwischen Cholesterin und Arteriosklerose bestreiten. Alle diese Briefe und seine unbewiesene These würden aber in entsprechenden Antworten sorgfältig widerlegt.[80]
Arzneimittel
Die ersten Mittel zur Senkung des Cholesterinspiegels waren Gallensäureaustauscherharze (Cholestipol). Später kamen dann Fibrate sowie Nikotinsäurepräparate und deren Derivate auf den Markt. Heute werden in diesem Indikationsbereich fast nur noch Statine und Cholesterinwiederaufnahmehemmer eingesetzt, in Einzelfällen noch Fibrate.
Fibrate
Derzeit sind die Wirkstoffe Bezafibrat, Fenofibrat und Gemfibrozil im Einsatz. Fibrate zeichnen sich durch eine gute Triglyceridsenkung aus und werden heute deshalb vor allem bei Diabetikern eingesetzt.
Statine
Als die zur Zeit wirksamsten Medikamente zur Senkung des Cholesterinspiegels gelten Statine. Sie gehören zur Gruppe der HMG-CoA-Reduktase-Hemmer (CSE-Hemmer), da sie das Schlüsselenzym der Cholesterinsynthese in der Zelle, die β-Hydroxy-β-methylglutaryl-Coenzym-A-Reduktase hemmen. Als Folge stellt die Zelle benötigtes Cholesterin nicht mehr selbst her, sondern nimmt Cholesterin aus dem Blut, über LDL-Rezeptoren, auf.
Ezetimib
Der Wirkstoff Ezetimib ist ein im Darm wirkender, selektiver Cholesterinwiederaufnahmehemmer (oder Cholesterol-Resorptionshemmer), der gezielt das Niemann-Pick C1-Like 1 (NPC1L1)-Protein blockiert. NPC1-L1 sitzt in der Membran von Enterozyten der Dünndarmwand und ist für die Aufnahme von Cholesterin und Phytosterolen aus dem Darm zuständig.
PCSK9-Hemmer
Das Enzym Proproteinkonvertase Subtilisin/Kexin Typ 9 (PCSK9) ist ein wichtiger intrinsischer Determinator des LDL-Spiegels. Es bindet den LDL-Rezeptor irreversibel und vermindert daher die Resorptionsrate von LDL aus dem Blut mit entsprechend höherem LDL-Spiegel. Bei einer seltenen Gen-Variante mit verminderter PCSK9-Aktivität zeigte sich ein deutlich geringerer LDL-Spiegel mit geringerer Rate koronarer Herzerkrankungen. Dies führte zur Entwicklung spezifischer gegen PCSK9 gerichteter monoklonaler Antikörper (PCSK9-Hemmer).
2015 wurden in der Europäischen Union die folgenden Arzneistoffe als PCSK9-Hemmer zugelassen: Alirocumab als Praluent der Firma Sanofi und Evolocumab als Repatha der Firma Amgen. Wirkungen und Anwendungsmöglichkeiten hängen von der Art der Patientengruppe ab und sind umfassend beschrieben worden.[81][82][83][84]
Schwerwiegende Nebenwirkungen wurden bisher nicht beschrieben. Als häufigste Nebenwirkungen sind allgemeine allergische Reaktionen und Reizungen im Bereich der Injektionsstelle zu nennen (bei je unter 10 % der Patienten).[85][86]
ATP-Citrat-Lyase-Hemmer
Mit Bempedoinsäure ist ein neuer Wirkmechanismus in Erprobung. Es wird ein Schlüsselenzym der Cholesterin-Biosynthese, die ATP-Citrat-Lyase, gehemmt. Bempedoinsäure ist ein Prodrug und erfordert eine Aktivierung durch das Enzym ACSVL1 (Very-long-chain-Acetyl-CoA-Synthetase 1), welches nur in der Leber, nicht jedoch in den meisten peripheren Zellen vorhanden ist.[87] Dieses ist ein wesentlicher Unterschied gegenüber den Statinen. In der CLEAR Harmony-Studie konnte gezeigt werden, dass Bempedoinsäure den LDL-Serumspiegel bei Patienten unter maximal tolerierter Statin-Dosis weiter senken kann.[88] Mit Bempedoinsäure betrug der Serumsspiegel von LDL-Cholesterin 12 Wochen nach Therapiebeginn 84,4 mg/dl, ohne 102,4 mg/dl. Eine Senkung der kardiovaskulären Sterblichkeit konnte nicht nachgewiesen werden. Seit Februar 2020 ist Bempedoinsäure in den USA (Nexletol),[89] seit April 2020 in der EU zugelassen (Nilemdo).[90]
Literatur
Biochemie und Physiologie
- Hans-Jürgen Holtmeier: Cholesterin. Zur Physiologie, Pathophysiologie und Klinik. Springer, Berlin 1996, ISBN 3-540-60671-8 (Umfassendes Buch)
- E. Buddecke: Grundriss der Biochemie. 5. Auflage. de Gruyter, Berlin 1977, ISBN 3-11-004796-9.
- Georg Löffler, Petro E. Petrides: Biochemie und Pathobiochemie. 8. Auflage. Springer, Heidelberg 2007, ISBN 978-3-540-32680-9.
Verteilung der Lipid-Werte in Deutschland
- Mustafa Kemal Porsch-Özcürümez: Vergleichende Untersuchung der Lipidstoffwechselparameter zwischen 35–64 jährigen deutschen und in Deutschland lebenden türkischen Teilnehmern einer Gesundheitsvorsorgeuntersuchung (Check-up 35). (PDF; 380 kB). Dissertation. Gießen 1997.
- Cholesterinmesswerte im Bundes-Gesundheitssurvey 1998 in Deutschland. Robert Koch-Institut
Vertreter der Cholesterin-KHK-Hypothese
- P. Schwandt, W. Richter, K. Parhofer: Handbuch der Fettstoffwechselstörungen. 2. Auflage. Schattauer, Stuttgart 2001, ISBN 3-7945-1977-9. (Die drei Herausgeber sind ehemalige Vorstände der Lipid-Liga)
- Christiane Eckert-Lill: Kampf dem Cholesterin. 2. Auflage. Govi, Eschborn 2003, ISBN 3-7741-0990-7. (Die Autorin fungiert als Geschäftsführerin Pharmazie der Bundesvereinigung der Apothekerverbände, ABDA)
Kritische Arbeiten zur Cholesterin-KHK-Hypothese
- Dieter Borgers, Michael Berger (Hrsg.): Cholesterin – Risiko für Prävention und Gesundheitspolitik. Blackwell Wissenschaft, Berlin/ Wien 1995, ISBN 3-89412-212-9.
- Uffe Ravnskov, Udo Pollmer: Mythos Cholesterin. 4., komplett überarbeitete u. ergänzte Auflage. Hirzel, Stuttgart 2008, ISBN 978-3-7776-2123-4.
- Jörg Blech: Die Krankheitserfinder. Wie wir zu Patienten gemacht werden. S. Fischer, Frankfurt 2003, ISBN 3-10-004410-X, S. 78 ff. (u. a. zur wirtschaftlichen Ausnutzung der Cholesterinproblematik)
- Ray Moynihan, Alan Cassels: Selling sickness. How the world’s biggest pharmaceutical companies are turning us all into patients. Nation Books, New York 2005, ISBN 1-56025-697-4.
- Walter Hartenbach: Die Cholesterin-Lüge. Das Märchen vom bösen Cholesterin. Herbig, München 2002, ISBN 3-7766-2277-6.
Sonstiges
- Axel W. Bauer: Cholesterin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 258–259.
Weblinks
- Deutsche Gesellschaft zur Bekämpfung von Fettstoffwechselstörungen und ihren Folgeerkrankungen DGFF (Lipid-Liga) e. V.
- US-amerikanische Richtlinien zur Behandlung von erhöhtem Cholesterin. (Memento vom 4. Oktober 2014 im Internet Archive) National Cholesterol Education Program – NCEP (englisch)
- The International Network of Cholesterol Skeptics (englisch) – Website von Wissenschaftlern, die dem Zusammenhang zwischen Cholesterinspiegel und Herz-Kreislauf-Erkrankungen kritisch gegenüberstehen
- Cholesterine, der große Bluff. Arte, 18. Oktober 2016. Kritische Auseinandersetzung mit der Theorie, dass zahlreiche Herz-Kreislauferkrankungen auf einen hohen Cholesterinspiegel zurückzuführen sind und mit Statinen erfolgreich behandelt werden können.
Einzelnachweise
- Eintrag zu CHOLESTEROL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu CAS-Nr. 57-88-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Oktober 2016. (JavaScript erforderlich)
- Cholesterin. In: Lexikon der Biologie. Spektrum Akademischer Verlag, Heidelberg, 1999.
- E. J. Behrman, Venkat Gopalan: Cholesterol and Plants In: Journal of Chemical Education, Dezember 2005, v82, n12; S. 1791–1792. doi:10.1021/ed082p1791.
- Agricultural Research Service (ARS): Butter, stick, unsalted In: FoodData Central.
- Voet Voet: Biochemistry. 2. Auflage. Verlag Wiley & Son’s, 1995, S. 694–704.
- Joachim Reitner, Klaus Weber, Ute Karg: Das System Erde – was bewegt die Welt? Lebensraum und Zukunftsperspektiven. (PDF; 1,7 MB). Universitätsverlag Göttingen, 2005.
- William J. Griffiths, Yuqin Wang: Sterolomics in biology, biochemistry, medicine. In: TrAC Trends in Analytical Chemistry. Band 120, 1. November 2019, ISSN 0165-9936, S. 115280, doi:10.1016/j.trac.2018.10.016, PMID 31839688 (sciencedirect.com [abgerufen am 17. August 2020]).
- Leland L. Smith: Cholesterol Autoxidation. Plenum Press, New York/ London 1981, ISBN 0-306-40759-0.
- B. Jassal: Cholesterol biosynthesis. auf: reactome.org
- B. Jassal: Metabolism of bile acids and bile salts. auf: reactome.org
- B.-L. Song, N. B. Javitt, R. A. DeBose-Boyd: Insig-mediated degradation of HMG CoA reductase stimulated by lanosterol, an intermediate in the synthesis of cholesterol. In: Cell Metabolism. Vol. 1, Nr. 3, 1. März 2005, S. 179–189, doi:10.1016/j.cmet.2005.01.001.
- H.-U. Melchert u. a.: Fatty acid patterns in triglycerides, diglycerides, free fatty acids, cholesteryl esters and phosphatidylcholine in serum from vegetarians and non-vegetarians. In: Atherosclerosis. Band 65, Nr. 1–2, 1987, S. 159–66. PMID 3606730
- Helmut Schröder u. a.: Relationship between body mass index, serum cholesterol, leisure-time physical activity, and diet in a Mediterranean Southern-Europe population. In: British Journal of Nutrition. Band 90, Nr. 02, 2003, S. 431–439.
- T. Colin Campbell, Thomas M. Campbell: The China Study: The Most Comprehensive Study of Nutrition Ever Conducted and the Startling Implications for Diet, Weight Loss and Long-term Health. Perseus Distribution, 2006, ISBN 1-932100-66-0, S. 444 (englisch).
- P. Joseph, D. Leong u. a.: Reducing the Global Burden of Cardiovascular Disease, Part 1: The Epidemiology and Risk Factors. In: Circulation research. Band 121, Nummer 6, September 2017, S. 677–694, doi:10.1161/CIRCRESAHA.117.308903, PMID 28860318 (Review), PDF.
- F. Farzadfar, M. M. Finucane u. a.: National, regional, and global trends in serum total cholesterol since 1980: systematic analysis of health examination surveys and epidemiological studies with 321 country-years and 3·0 million participants. In: The Lancet. Band 377, Nummer 9765, Februar 2011, S. 578–586, doi:10.1016/S0140-6736(10)62038-7, PMID 21295847, PDF.
- Clin Chem. 18, 1972, S. 449–502.
- C. S. Briche, D. Carter, K. S. Webb: Comparison of gas chromatography and liquid chromatography mass spectrometric measurements for high accuracy analysis of cholesterol in human serum by isotope dilution mass spectrometry. In: Rapid Commun Mass Spectrom. Band 16, Nr. 9, 2002, S. 848–853. PMID 11948815
- A. Takatsu, S. Nishi: Total cholesterol in serum determined by isotope dilution/mass spectrometry, with liquid-chromatographic separation. In: Clin Chem. Band 33, Nr. 7, Jul 1987, S. 1113–7. PMID 3297419
- Risk of fatal coronary heart disease in familial hypercholesterolaemia. In: BMJ. Band 303, Nr. 6807, 12. Okt 1991, S. 803–806.
- Leo E. Akioyamen, Jacques Genest, Shubham D. Shan, Rachel L. Reel, Jordan M. Albaum: Estimating the prevalence of heterozygous familial hypercholesterolaemia: a systematic review and meta-analysis. In: BMJ open. Band 7, Nr. 9, 1. September 2017, ISSN 2044-6055, S. e016461, doi:10.1136/bmjopen-2017-016461, PMID 28864697, PMC 5588988 (freier Volltext) – (nih.gov).
- M. K. Ito, M. P. McGowan, P. M. Moriarty: Management of familial hypercholesterolemias in adult patients: recommendations from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. In: J Clin Lipidol. Band 5, 3 Suppl, Juni 2011, S. S38–S45, doi:10.1016/j.jacl.2011.04.001, PMID 21600528.
- Walter Siegenthaler: Siegenthalers Differentialdiagnose: Innere Krankheiten- vom Symptom zur Diagnose. 19. Auflage. Georg Thieme Verlag, 2005, ISBN 3-13-344819-6, S. 1060.
- Hamid A. Emminger, Thomas Kia: Exaplan: das Kompendium der klinischen Medizin, Band 2. 5. Auflage. Elsevier, Urban & Fischer-Verlag, 2007, ISBN 978-3-437-42462-5, S. 958.
- Walter Siegenthaler: Klinische Pathophysiologie. 9. Auflage. Georg Thieme Verlag, 2006, ISBN 3-13-449609-7, S. 218.
- A. Keys, J. T. Anderson, F. Grande: Serum cholesterol response to changes in the diet: II. The effect of cholesterol in the diet. In: Metabolism. Band 14, Nr. 7, Jul 1965, S. 759–765. doi:10.1016/0026-0495(65)90002-8. PMID 25286460.
- Brian A. Ference, Henry N. Ginsberg, Ian Graham, Kausik K. Ray, Chris J. Packard: Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. In: European Heart Journal. Band 38, Nr. 32, 21. August 2017, ISSN 0195-668X, S. 2459–2472, doi:10.1093/eurheartj/ehx144 (oup.com [abgerufen am 18. Februar 2021]).
- Risk of fatal coronary heart disease in familial hypercholesterolaemia. Scientific Steering Committee on behalf of the Simon Broome Register Group. In: BMJ. Band 303, Nummer 6807, Oktober 1991, S. 893–896. PMID 1933004. PMC 1671226 (freier Volltext).
- hil: Vorwurf der Cholesterinlüge entkräftet. In: Deutsches Ärzteblatt. Jahrgang 36, Nr. 105, 2008, S. A-1812 (aerzteblatt.de).
- Brian A. Ference, Henry N. Ginsberg, Ian Graham, Kausik K. Ray, Chris J. Packard: Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. In: European Heart Journal. Band 38, Nr. 32, 21. August 2017, ISSN 0195-668X, S. 2459–2472, doi:10.1093/eurheartj/ehx144 (oup.com [abgerufen am 18. Februar 2021]).
- Ancel Keys 7 Countries Study: Still accurate, actionable and relevant
- ATP 3 Cholesterol Guidelines, NHLBI (Memento vom 5. August 2012 im Webarchiv archive.today)
- DGFF (Lipid-Liga, März 2005): Vereinheitlichung von Referenzwerten für das Lipidprofil auf Laborberichten. (Nicht mehr online verfügbar.) Archiviert vom Original am 19. September 2008; abgerufen am 18. November 2008.
- Daniel G. Hackam, Robert A. Hegele: Cholesterol Lowering and Prevention of Stroke. In: Stroke. Band 50, Nr. 2, 1. Februar 2019, S. 537–541, doi:10.1161/STROKEAHA.118.023167.
- Binlu Huang, Bao-liang Song, Chenqi Xu: Cholesterol metabolism in cancer: mechanisms and therapeutic opportunities. In: Nature Metabolism. Band 2, Nr. 2, Februar 2020, ISSN 2522-5812, S. 132–141, doi:10.1038/s42255-020-0174-0 (nature.com [abgerufen am 16. Oktober 2021]).
- J. B. Lopez-Saez, J. A. Martinez-Rubio, M. M. Alvarez, C. G. Carrera, Dominguez Villar M, A. G. de Lomas Mier, C. Doménech, A. Senra-Varela: Metabolic Profile of Breast Cancer in a Population of Women in Southern Spain. In: Open Clin Cancer J. Band 2, Nr. 18. Jan 2008, S. 1–6. PMID 18665244.
- G. Ray, S. A. Husain: Role of lipids, lipoproteins and vitamins in women with breast cancer. In: Clin Biochem. Band 34, Nr. 1, Feb 2001, S. 71–76. PMID 11239519.
- E. R. Nelson, S. E. Wardell, J. S. Jasper, S. Park, S. Suchindran, M. K. Howe, N. J. Carver, R. V. Pillai, P. M. Sullivan, V. Sondhi, M. Umetani, J. Geradts, D. P. McDonnell: 27-Hydroxycholesterol Links Hypercholesterolemia and Breast Cancer Pathophysiology. In: Science. Band 342, 2013, S. 1094–1098, doi:10.1126/science.1241908.
- Xiao Ding, Weihua Zhang, Song Li, Hui Yang: The role of cholesterol metabolism in cancer. In: American Journal of Cancer Research. Band 9, Nr. 2, 1. Februar 2019, ISSN 2156-6976, S. 219–227, PMID 30906624, PMC 6405981 (freier Volltext).
- J. Zhang u. a.: Association of serum cholesterol and history of school suspension among school-age children and adolescents in the United States. In: Am J Epidemiol. Band 161, Nr. 7, 2005, S. 691–699. PMID 15781958.
- Edward C. Suarez: Relations of Trait Depression and Anxiety to Low Lipid and Lipoprotein Concentrations in Healthy Young Adult Women. In: Psychosomatic Medicine. Band 61, 1999, S. 273–279.
- Claudia Johanna Wagner, Cornelia Musenbichler, Lea Böhm, Katharina Färber, Anna-Isabell Fischer: LDL cholesterol relates to depression, its severity, and the prospective course. In: Progress in Neuro-Psychopharmacology and Biological Psychiatry. Band 92, 8. Juni 2019, ISSN 0278-5846, S. 405–411, doi:10.1016/j.pnpbp.2019.01.010 (sciencedirect.com [abgerufen am 18. Februar 2021]).
- The Association between Depressive Mood and Cholesterol Levels in Korean Adolescents. Abgerufen am 16. Februar 2021.
- A. Steptoe, L. Brydon: Associations Between Acute Lipid Stress Responses and Fasting Lipid Levels 3 Years Later. In: Health Psychology. Vol. 24, No. 6, 2005, S. 601–607.
- V. W. Henderson, J. R. Guthrie, L Dennerstein: Serum lipids and memory in a population based cohort of middle age women. In: Journal of Neurology, Neurosurgery, and Psychiatry. Band 74, Nr. 11, 2003, doi:10.1136/jnnp.74.11.1530.
- High Cholesterol and Blood Pressure in Middle Age Tied to Early Memory Problems. Abgerufen am 19. Februar 2021.
- Better memory and thinking seen in over 85s despite high cholesterol. In: Alzheimer's Research UK. 5. März 2018, abgerufen am 19. Februar 2021 (britisches Englisch).
- Better memory and thinking seen in over 85s despite high cholesterol. In: Alzheimer's Research UK. 5. März 2018, abgerufen am 19. Februar 2021 (britisches Englisch).
- Cholesterol and dementia. Abgerufen am 19. Februar 2021 (englisch).
- Thomas S. Wingo, David J. Cutler, Aliza P. Wingo, Ngoc-Anh Le, Gil D. Rabinovici: Association of Early-Onset Alzheimer Disease With Elevated Low-Density Lipoprotein Cholesterol Levels and Rare Genetic Coding Variants of APOB. In: JAMA Neurology. Band 76, Nr. 7, 1. Juli 2019, ISSN 2168-6149, S. 809, doi:10.1001/jamaneurol.2019.0648 (jamanetwork.com [abgerufen am 19. Februar 2021]).
- Harvard Health Publishing: Can we reduce vascular plaque buildup? Abgerufen am 17. Februar 2021.
- FAQ 2. Version Fettleitlinie. Abgerufen am 19. Februar 2021.
- Foods that are high in cholesterol. Abgerufen am 19. Februar 2021 (englisch).
- Eierverzehr und kardiometabolische Erkrankungen: eine Bestandsaufnahme. (PDF) DGE, abgerufen am 2. März 2021.
- Dietary Guidelines for Americans 2020–2025. S. 44 (dietaryguidelines.gov [PDF]).
- Ghada A. Soliman: Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease. In: Nutrients. Band 10, Nr. 6, 16. Juni 2018, ISSN 2072-6643, S. 780, doi:10.3390/nu10060780, PMID 29914176, PMC 6024687 (freier Volltext).
- Maria Luz Fernandez: Dietary cholesterol provided by eggs and plasma lipoproteins in healthy populations. In: Current Opinion in Clinical Nutrition and Metabolic Care. Band 9, Nr. 1, Januar 2006, ISSN 1363-1950, S. 8–12, doi:10.1097/01.mco.0000171152.51034.bf, PMID 16340654.
- Hans Ulrich Melchert, Hans Hoffmeister: Rolle der Nahrungsfette und der Blutlipide in der multifaktoriellen Genese und in der Prävention kardiovaskulärer Krankheiten. (= SozEp-Berichte. 1981,5). D. Reimer Verlag, Berlin 1981, ISBN 3-496-02111-X.
- Empfehlungen der Lipid Liga. (PDF) Abgerufen am 19. Februar 2021.
- European Food Safety Authority (EFSA): Scientific Opinion on the substantiation of health claims related to beta-glucans from oats and barley and maintenance of normal blood LDL-cholesterol concentrations (ID 1236, 1299), increase in satiety leading to a reduction in energy intake (ID 851, 852), reduction of post-prandial glycaemic responses (ID 821, 824), and “digestive function” (ID 850) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. In: EFSA Journal . Band 9, Nr. 6, 2011, S. 2207.
- Daniel T Dibaba: Effect of vitamin D supplementation on serum lipid profiles: a systematic review and meta-analysis. In: Nutrition Reviews. Band 77, Nr. 12, 13. August 2019, ISSN 0029-6643, S. 890–902, doi:10.1093/nutrit/nuz037, PMID 31407792.
- Sun Ha Jee, Jiang He, Lawrence J. Appel, Paul K. Whelton, I. I. Suh: Coffee Consumption and Serum Lipids: A Meta-Analysis of Randomized Controlled Clinical Trials. In: American Journal of Epidemiology. Band 153, Nr. 4, 15. Februar 2001, ISSN 0002-9262, S. 353–362, doi:10.1093/aje/153.4.353 (oup.com [abgerufen am 1. März 2021]).
- Is There a Link Between Coffee and High Cholesterol? 29. Januar 2021, abgerufen am 1. März 2021 (englisch).
- Monica Dinu, Rosanna Abbate, Gian Franco Gensini, Alessandro Casini, Francesco Sofi: Vegetarian, vegan diets and multiple health outcomes: A systematic review with meta-analysis of observational studies. In: Critical Reviews in Food Science and Nutrition. Band 57, Nr. 17, 22. November 2017, ISSN 1549-7852, S. 3640–3649, doi:10.1080/10408398.2016.1138447, PMID 26853923 (researchgate.net [PDF]).
- Wang F, Zheng J, Yang B, Jiang J, Fu Y, Li D: Effects of Vegetarian Diets on Blood Lipids: A Systematic Review and Meta-Analysis of Randomized Controlled Trials.. In: J Am Heart Assoc. 4, Nr. 10, 2015, S. e002408. doi:10.1161/JAHA.115.002408. PMID 26508743. PMC 4845138 (freier Volltext).
- Yokoyama Y, Levin SM, Barnard ND: Association between plant-based diets and plasma lipids: a systematic review and meta-analysis.. In: Nutr Rev. 75, Nr. 9, 2017, S. 683-698. doi:10.1093/nutrit/nux030. PMID 28938794. PMC 5914369 (freier Volltext).
- H. Varleman: Ernährung bei Lipidstoffwechselstörungen. In: J. Stein, K.-W. Jauch (Hrsg.): Praxishandbuch klinische Ernährung und Infusionstherapie. Springer-Verlag, 2013, ISBN 978-3-642-55896-2, S. 679.
- L. Hooper, C. D. Summerbell, R. Thompson, D. Sills, F. G. Roberts, H. J. Moore, G. Davey Smith: Reduced or modified dietary fat for preventing cardiovascular disease. In: The Cochrane database of systematic reviews. Band 5, 2012, S. CD002137, doi:10.1002/14651858.CD002137.pub3. PMID 22592684 (Review).
- Milk, meat and blood: how diet drives natural selection in the Maasai. In: Wired. ISSN 1059-1028 (wired.com [abgerufen am 19. Februar 2021]).
- M. G. Marmot, S. L. Syme, A. Kagan, H. Kato, J. B. Cohen: Epidemiologic studies of coronary heart disease and stroke in Japanese men living in Japan, Hawaii and California: prevalence of coronary and hypertensive heart disease and associated risk factors. In: American Journal of Epidemiology. Band 102, Nr. 6, Dezember 1975, ISSN 0002-9262, S. 514–525, doi:10.1093/oxfordjournals.aje.a112189, PMID 1202953.
- New Review Study Shows That Egg-Industry-Funded Research Downplays the Danger of Cholesterol. Abgerufen am 16. Februar 2021 (englisch).
- N. D. Barnard, M. B. Long, J. M. Ferguson, R. Flores, H. Kahleova: Industry Funding and Cholesterol Research: A Systematic Review. In: American Journal of Lifestyle Medicine. 2019. doi:10.1177/1559827619892198.
- Cholesterinsenker aus dem Supermarkt: Nicht für jeden geeignet. Abgerufen am 4. Mai 2021.
- A. Helgadottir, G. Thorleifsson u. a.: Genetic variability in the absorption of dietary sterols affects the risk of coronary artery disease. In: European heart journal. Band 41, Nummer 28, 07 2020, S. 2618–2628, doi:10.1093/eurheartj/ehaa531, PMID 32702746, PMC 7377579 (freier Volltext).
- Atherosklerose: Gene der Cholesterinresorption sind relevant. In: DMW - Deutsche Medizinische Wochenschrift. 146, 2021, S. 220, doi:10.1055/a-1248-0040.
- Die Cholesterin-Bombe: Millionen Menschen halten streng Diät und nehmen Statine ein, um ihren Cholesterinspiegel zu senken. Umsonst, sagen einige Wissenschaftler. spektrum.de
- Uffe Ravnskov: Atherosclerosis and coronary heart disease have nothing to do with the diet.
- Jan I. Pedersen, Kaare R. Norum, Philip T. James, Ingeborg A. Brouwer, Martijn B. Katan: Response to Ravnskov et al. on saturated fat and CHD. In: British Journal of Nutrition. Band 107, Nr. 3, Februar 2012, ISSN 1475-2662, S. 458–460, doi:10.1017/S0007114511006611 (cambridge.org [abgerufen am 17. Februar 2021]).
- Jan I. Pedersen, Kaare R. Norum, Philip T. James, Ingeborg A. Brouwer, Martijn B. Katan: Response to Ravnskov et al. on saturated fat and CHD. In: British Journal of Nutrition. Band 107, Nr. 3, Februar 2012, ISSN 1475-2662, S. 458–460, doi:10.1017/S0007114511006611 (cambridge.org [abgerufen am 17. Februar 2021]).
- Binod Pokhrel, Wei C. Yuet, Steven N. Levine: PCSK9 Inhibitors, StatPearls Publishing, Jan 2021, PMID 28846236 (Review) (Freier Volltext).
- E. Gallego-Colon, A. Daum, C. Yosefy: Statins and PCSK9 inhibitors: A new lipid-lowering therapy. In: European journal of pharmacology. Band 878, Juli 2020, S. 173114, doi:10.1016/j.ejphar.2020.173114, PMID 32302598 (Review).
- R. H. Furtado, R. P. Giugliano: What Lessons Have We Learned and What Remains to be Clarified for PCSK9 Inhibitors? A Review of FOURIER and ODYSSEY Outcomes Trials. In: Cardiology and therapy. Band 9, Nummer 1, Juni 2020, S. 59–73, doi:10.1007/s40119-020-00163-w, PMID 32026310, PMC 7237602 (freier Volltext) (Review).
- N. D. Wong, P. P. Toth, E. A. Amsterdam: Most important advances in preventive cardiology during this past decade: Viewpoint from the American Society for Preventive Cardiology. In: Trends in cardiovascular medicine. Band 31, Nummer 1, 01 2021, S. 49–56, doi:10.1016/j.tcm.2019.11.013, PMID 31882264 (Review).
- Fachinformation der Firma Sanofi zu Praluent: allgemeine allergische Reaktionen 8,1 %, Reizungen im Bereich der Injektionsstelle 6,1 %.
- Fachinformation der Firma Amgen zu Repatha: allgemeine allergische Reaktionen unter 10 %, Reizungen im Bereich der Injektionsstelle unter 10 % (keine detaillierteren Angaben).
- Stephen L Pinkosky, Roger S Newton, Emily A Day, Rebecca J Ford, Sarka Lhotak: Liver-specific ATP-citrate lyase inhibition by bempedoic acid decreases LDL-C and attenuates atherosclerosis. In: Nature Communications. Band 7, 28. November 2016, S. 13457, doi:10.1038/ncomms13457, PMID 27892461, PMC 5133702 (freier Volltext).
- Kausik K Ray, Harold E Bays, Alberico L Catapano, Narendra D Lalwani, LeAnne T Bloedon: Safety and Efficacy of Bempedoic Acid to Reduce LDL Cholesterol. In: New England Journal of Medicine. Band 380, Nr. 11, 14. März 2019, S. 1022–1032, doi:10.1056/NEJMoa1803917.
- FDA-Approved Drugs - Nexletol. Abgerufen am 17. März 2021.
- European Public Assessment report (EPAR) - Nilemdo. Abgerufen am 17. März 2021.