Vanadocen
Vanadocen, oder auch Bis(cyclopentadienyl)vanadium, abgekürzt VCp2 ist eine metallorganische Verbindung aus der Familie der Metallocene. Es bildet einen dem Ferrocen analogen Sandwichkomplex, folgt aber nicht der 18-Elektronen-Regel, da es nur 15 Valenzelektronen besitzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
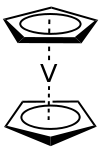 | ||||||||||||||||
| Gestaffelte Konformation | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Vanadocen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H10V | |||||||||||||||
| Kurzbeschreibung |
purpurner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 181,128 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
zersetzt sich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Vanadocen wurde zuerst 1954 von Birmingham, Fischer und Wilkinson durch Reduktion von Vanadocendichlorid mit Aluminiumhydrid hergestellt. Das Vanadocen wurde danach bei 100 °C sublimiert.[4]
1977 beschrieben Köhler et al. die Herstellung von Vanadocen durch die Umsetzung des Vanadiumkomplexes [V2Cl3(THF)6]2[Zn2Cl6] mit Cyclopentadienylnatrium:[5][6]
Wird Vanadium(III)-chlorid direkt mit Cyclopentadienylnatrium umgesetzt, wirkt letzteres als Reduktionsmittel und es entsteht als Nebenprodukt durch die Kopplung zweier Cp-Reste das Dihydrofulvalen:[7]
Eigenschaften
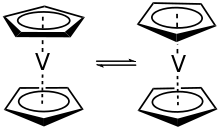
Vanadocen ist ein purpurfarbener, kristalliner, paramagnetischer Feststoff. Im festen Zustand haben die Moleküle D5d Symmetrie. Das Vanadium(II)ion liegt im Symmetriezentrum äquidistant zwischen den beiden Cyclopentadienyl-Ringen. Die durchschnittliche V–C-Bindungslänge liegt bei 226 pm und der Abstand der Ringe bei 390 pm.[8][9] Die Cyclopentadienyl-Ringe im Vanadocen sind bei einer Temperatur über 170 K dynamisch gestört und nur unterhalb von 108 K vollständig geordnet. Die Dissoziationsenergie für die Cp–V-Bindung wird, je nach Literatur, mit 145 kJ·mol−1 bzw. 369 kJ·mol−1 angegeben.[10][11]
Reaktionen
Das Vanadocen ist ein reaktives Molekül. Es lässt sich durch Umsetzung mit einem Ferrocenium-Salz in Toluol leicht zum Monokation oxidieren:[12]
Da Vanadocen nur über 15 Valenzelektronen verfügt, reagiert es bereitwillig mit weiteren Liganden. Mit Acetylenderivaten reagiert Vanadocen z. B. zu den entsprechenden Vanadiumcyclopropenkomplexen:[6]
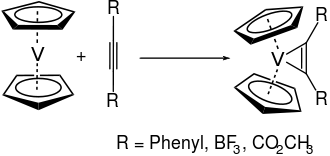
Beim reduktiven Ringaustausch mit Butyllithium in Gegenwart von 1,3-Cyclohexadien lässt sich ein Cyclopentadienylring des Vanadocens durch einen Benzolring ersetzen:[13]
Einzelnachweise
- Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 452 in der Google-Buchsuche).
- Electrochemical Society: Proceedings of the Thirteenth International Conference on Chemical Vapor. 1996, ISBN 978-1-56677-155-9 (Seite 757 in der Google-Buchsuche).
- Datenblatt Bis(cyclopentadienyl)vanadium(II) bei Sigma-Aldrich, abgerufen am 8. Dezember 2011 (PDF).
- J. M. Birmingham, A. K. Fischer, G. Wilkinson: The Reduction of Bis-cyclopentadienyl Compounds. In: Naturwissenschaften. 42, Nr. 4, 1955, S. 96. doi:10.1007/BF00617242.
- C. Lorber: „Vanadium Organometallics.“ Chapter 5.01. Comprehensive Organometallic Chemistry III. Elsevier, 2007. 1-60.
- Markus Jordan: Azine in der Koordinationssphäre von Vanadocenderivaten unterschiedlicher Oxidationsstufen. Oldenburg 2009, DNB 996730079, urn:nbn:de:gbv:715-oops-8831 (Dissertation, Universität Oldenburg).
- Integriertes Synthesepraktikum (ISP) Uni Hamburg: Vanadocen, (PDF; 58 kB).
- Robin D. Rogers, Jerry L. Atwood, Don Foust, Marvin D. Rausch: Crystal Structure of Vanadocene. In: Journal of Crystal and Molecular Structure. 11, Nr. 5–6, 1981, S. 183–188. doi:10.1007/BF01210393.
- F. Jellinek: Die Struktur des Osmocens. In: Zeitschrift für Naturforschung B. 14, 1959, S. 737–738 (online).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1699–1703.
- James E. Huheey, Ellen A. Keiter, Richard Keiter: Anorganische Chemie: Prinzipien von Struktur und Reaktivität. de Gruyter Verlag, 2003, ISBN 3-11-017903-2 (Seite 797 in der Google-Buchsuche).
- Fausto Calderazzo, Isabella Ferri, Guido Pampaloni, Ulli Englert: Oxidation Products of Vanadocene and of Its Permethylated Analogue, Including the Isolation and the Reactivity of the Unsolvated [VCp]Cation. In: Organometallics. 18, Nr. 13, 1999, S. 2452–2458. doi:10.1021/om9809320.
- Thomas Kupfer: Darstellung und Charakterisierung von gespannten [n]Metalloarenophanen und Borolen. Würzburg 2007, DNB 986490075, urn:nbn:de:bvb:20-opus-24999 (Dissertation, Universität Würzburg).
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1699–1703.
- SKRIPTUM zum Modul AC-4(Sundermeyer) Uni Marburg, S. 148–151 (PDF; 1,7 MB).

