Natriumselenid
Natriumselenid ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Selenide.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
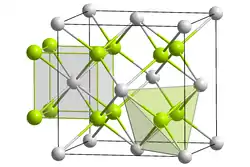 | ||||||||||||||||
| _ Se2− _ Na+ | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumselenid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Na2Se | |||||||||||||||
| Kurzbeschreibung |
rotes Pulver mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 124,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,625 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Natriumselenid kann durch Reaktion von Natrium mit Selen in Ammoniak gewonnen werden.[3]
Bei einem Überschuss an Selen entstehen auch Natriumdiselenid Na2Se2, Natriumtriselenid Na2Se3, Natriumtetraselenid Na2Se4 und Natriumhexaselenid Na2Se6, welche graue und an feuchter Luft instabile Feststoffe darstellen.[4][5]
Bei der Reaktion von Selen mit Hydrazin und Natriumhydroxid entsteht Natriumdiselenid, welches mit Natriumdithionit zu Natriumselenid reduziert werden kann.[6]
Eigenschaften
Natriumselenid ist ein hygroskopisches rotes Pulver mit unangenehmem Geruch, das sich in Wasser zersetzt.[1]
In Reinform ist es weiß und löslich in Wasser, zerfließt aber an Luft unter Rotfärbung durch Selenabscheidung und Bildung von Polyseleniden. Es hat eine kubische Kristallstruktur (vom anti-Calciumfluorid-Typ[7]) mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225).[2] Von der Verbindung sind auch vier Hydrate bekannt.[4]
Mit Chlorwasserstoff reagiert es zu Selenwasserstoff.[8]
Verwendung
Natriumselenid kann für organische Synthesen verwendet werden.[9]
Einzelnachweise
- Eintrag zu Natriumselenid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer DE, 1997, ISBN 3-540-60035-3, S. 626 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie 3. Ausgabe, Band 1, Ferdinand Enke Verlag Stuttgart 1975, S. 415.
- J. Newton Friend: A Text-Book of Inorganic Chemistry. Forgotten Books, 2012, ISBN 978-1-4510-0469-4, S. 147 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- Christos D. Malliakas: Charge Density Waves and Structural Modulations in Polytelluride Compounds. ProQuest, 2008, ISBN 978-0-549-61737-2, S. 5 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas Wirth: Organoselenium Chemistry: Modern Developments in Organic Synthesis. Springer, 2000, ISBN 3-540-66516-1, S. 60 (eingeschränkte Vorschau in der Google-Buchsuche).
- Will Kleber, Joachim Bohm: Einführung in die Kristallographie. Oldenbourg Verlag, 1998, ISBN 3-486-27319-1, S. 142 (eingeschränkte Vorschau in der Google-Buchsuche).
- G. Singh: Chemistry Of Lanthanides And Actinides. Discovery Publishing House, 2007, ISBN 978-81-8356-241-6, S. 250 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas G. Back: Organoselenium Chemistry: A Practical Approach. Oxford University Press, 1999, ISBN 0-19-850141-2, S. 116 (eingeschränkte Vorschau in der Google-Buchsuche).


