Selenwasserstoff
Selenwasserstoff, auch Monoselan, ist eine Verbindung aus Selen und Wasserstoff. Sie entsteht beim Auflösen salzartiger Selenide in verdünnten Säuren. Selenwasserstoff ist ein farbloses, äußerst giftiges Gas mit unangenehm fauligem Geruch. Bereits einmaliges Einatmen kleiner Mengen führt zu unangenehmen, lange anhaltenden Reizungen der Schleimhäute (sog. „Selenschnupfen“). Selenwasserstoff ist giftiger als Schwefelwasserstoff. Bei Laborversuchen, bei denen auch nur sehr geringe Mengen Selenwasserstoff entstehen, muss unbedingt unter einem Abzug gearbeitet werden und ein gasdichter Schutzanzug getragen werden.
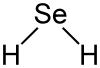
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Selenwasserstoff | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | H2Se | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit unangenehmem Geruch nach faulem Rettich[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,98 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−41,4 °C (Zersetzung oberhalb von 150 °C)[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (9,8 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Brechungsindex |
1,412 (16,85 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Selenwasserstoff dient in der Halbleiter- und Elektronikindustrie zur Dotierung von Halbleitern.
Physikalische Eigenschaften

Selenwasserstoff ist gewinkelt gebaut (Bindungswinkel 91°), die Bindungslänge Se–H beträgt 146 pm.[5]
| Eigenschaft | Wert |
|---|---|
| Kritische Temperatur | 138 °C[6] |
| Kritischer Druck | 8,92 MPa[6] |
| Kritische Dichte | 0,76 kg/l |
| Tripelpunkt Temperatur | −65,65 °C |
| Tripelpunkt Druck | 0,2738 bar |
Chemische Eigenschaften
Im Vergleich zu Schwefelwasserstoff ist Selenwasserstoff ein stärkeres Reduktionsmittel. Wässrige Lösungen von Selenwasserstoff reagieren mit Luftsauerstoff, wobei rotes Selen ausfällt.[7]
Herstellung
Zu reinem Selenwasserstoff führt im Labor das Auflösen von trockenem Aluminiumselenid in Wasser, oder eine Reaktion der Elemente bei 400 °C:[8]
Verwendung
Durch Reaktion mit einer Kaliumantimonyltartratlösung kann Antimon(III)-selenid hergestellt werden.[9]
Einzelnachweise
- Eintrag zu Selenwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- P. G. Sennikov, V. E. Shkrunin, D. A. Raldugin, K. G. Tokhadze: Weak Hydrogen Bonding in Ethanol and Water Solutions of Liquid Volatile Inorganic Hydrides of Group IV-VI Elements (SiH4, GeH4, PH3, AsH3, H2S, and H2Se). 1. IR Spectroscopy of H Bonding in Ethanol Solutions in Hydrides. In: The Journal of Physical Chemistry. Band 100, Nr. 16, Januar 1996, ISSN 0022-3654, S. 6415–6420, doi:10.1021/jp953245k.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7783-07-5 bzw. Selenwasserstoff), abgerufen am 2. November 2015.
- Stoffliste (MAK-Werte und TRK-Werte), Verordnung des Bundesministers für Arbeit über Grenzwerte für Arbeitsstoffe sowie über krebserzeugende und fortpflanzungsgefährdende (reproduktionstoxische) Arbeitsstoffe (Grenzwerteverordnung 2021 – GKV), Österreich, abgerufen am 27. August 2021.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 627.
- Eintrag zu Selenwasserstoff. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 528.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., Band 1, Academic Press 1963, S. 418–419.
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 39 (eingeschränkte Vorschau in der Google-Buchsuche).



