Selensäure
Selensäure ist eine starke (ähnlich wie Schwefelsäure) anorganische Säure mit der Summenformel H2SeO4. In wässriger Lösung liegt sie weitgehend dissoziiert vor und bildet eine klare, farblose Flüssigkeit. Die Selensäure wurde von Eilhard Mitscherlich 1827 in Deutschland entdeckt. Ihre Salze heißen Selenate.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
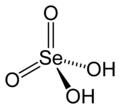 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Selensäure | |||||||||||||||||||||
| Summenformel | H2SeO4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose hexagonale Prismen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 144,97 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
2,95 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzt sich ab 260 °C[2] | |||||||||||||||||||||
| pKS-Wert |
1,74 (pKs2)[3] | |||||||||||||||||||||
| Löslichkeit |
gut in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
0,05 mg·m−3[2] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung
Die Selensäure kann auf verschiedene Arten dargestellt werden.
Eine Möglichkeit ist die Oxidation von Seleniger Säure (H2SeO3) oder Selen(IV)-oxid mit Wasserstoffperoxid (H2O2), Kaliumpermanganat (KMnO4) oder Chlorsäure (HClO3):[5]
In der Regel wird jedoch elementares Selen mit Chlor- oder Bromwasser oxidiert:
Eigenschaften
Reine Selensäure bildet farblose Kristalle, die bei etwa 62 °C schmelzen. Oberhalb von 260 °C zersetzt sie sich unter Wasserabspaltung zu Selendioxid und Sauerstoff.
Selensäure hat chemisch gesehen große Ähnlichkeit mit der Schwefelsäure, wirkt jedoch bedeutend stärker oxidierend (Standardpotential in saurer Lösung für die Reduktion zu Seleniger Säure: + 1,15 V[3]). Sie ist eine starke Säure und wirkt hygroskopisch. Dies bedeutet, dass sie, ebenso wie konzentrierte Schwefelsäure, organische Substanzen durch Wasserentzug verkohlt. Selensäure ist wie Königswasser in der Lage, Gold und Platin in Lösung zu bringen[6]:
Ein Gemisch aus Selensäure und Salzsäure bildet analog zum Königswasser naszierendes Chlor.
Dieses Gemisch vermag ebenfalls Gold unter Bildung von Chlorokomplexen zu lösen.[7]
Die Salze der Selensäure (die Selenate) haben oftmals ein niedriges Löslichkeitsprodukt in Wasser, ähnlich den Sulfaten.
Sicherheitshinweise
Selensäure wirkt auf Haut, Atemwege und Schleimhäute stark reizend. Sie ist in der Lage lebendes Gewebe zu zerstören (Verätzung). Aussetzung mit der Verbindung über einen längeren Zeitraum kann schwere physiologische Schäden verursachen. Selensäure ist giftig. Bei Intoxikationen mit Selenverbindungen muss mit bleibenden Schäden gerechnet werden.[2]
Verwendung
Durch Reaktion von Cadmiumoxid mit konzentrierter Selensäure kann Cadmiumselenat gewonnen werden.[8]
Einzelnachweise
- Eintrag zu Selensäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juli 2014.
- Eintrag zu Selensäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 25. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 432–3.
- Dr. Heinrich Remy: Lehrbuch der Anorganischen Chemie Band I, Seite 909, Leipzig 1970, Akademische Verlagsgesellschaft Geest & Portig K.-G.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, 2011, ISBN 3-11-022566-2, S. 458.
- C. Stålhandske: Structure of cadmium selenate monohydrate. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 37, S. 2055, doi:10.1107/S0567740881007942.



