Selensulfide
Als Selensulfide bezeichnet man die Verbindungen aus Schwefel und Selen. Die Einzelverbindungen liegen nach der Herstellung über die gängigen Synthesewege jedoch als Stoffgemisch vor, das auf Grund der durchschnittlichen Verhältnisformel häufig auch Selendisulfid genannt wird.
Eigenschaften
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Name |
Selendisulfid | ||||||||
| CAS-Nummer | |||||||||
| |||||||||
Das Gemisch der Selensulfide besteht aus Achtringen mit der variablen Zusammensetzung (SenS8−n), wobei das Selenmonosulfid[2] und Diselenhexasulfid[3] Einzelverbindungen sind.[4][5]
Selensulfide Strukturformel 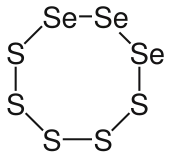
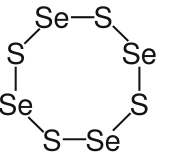
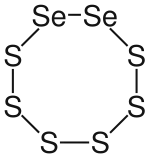
Name 1,2,3-Se3S5 1,3,5,7-Se4S4
Selenmonosulfid1,2-Se2S6
DiselenhexasulfidCAS-Nummer 75926-27-1 7446-34-6 75926-26-0 PubChem 24011 11121651
Aufgrund der typischen Zusammensetzung des Gemischs mit der Verhältnisformel SeS2 wird häufig auch von Selendisulfid gesprochen. Es ist ein hell-orangefarbenes bis rotbraunes, in Wasser unlösliches Pulver und hat einen Schmelzpunkt von < 100 °C.[1] Bei der Einwirkung von Säuren entstehen giftige Schwefelwasserstoff-Dämpfe.
Die einzelnen Selensulfide sind in kristalliner Form mehr oder weniger metastabil. Beim sukzessiven Erwärmen wandeln sie sich spätestens beim Schmelzpunkt in Selensulfidgemische um und polymerisieren in unterschiedlichem Ausmaß. Aus Kohlenstoffdisulfid kristallisieren Gemische, welche die erste und dritte Form in wechselnden Anteilen enthalten. In Kohlenstoffdisulfidlösung erfolgt der Übergang in andere Selensulfide bereits bei Raumtemperatur mehr oder weniger rasch. Zum Beispiel geht unter den siebengliederigen Ringen 1,2-Se2S5 bei 25 °C mit einer Halbwertszeit von ca. 1 h in den sechsgliedrigen Ring SeS5 sowie den achtgliederigen Ring 1,2,3-Se3S5 über. Etwas rascher zersetzt sich Se5S2 in Se4S2 und Se6S2. Der sechsgliederige Ring Se5S verwandelt sich andererseits in die Sulfide Se7S, Se6S und Se5S3 und – nach längeren Reaktionszeiten – auch in Se8 und Se6S2. Entsprechend tendieren Selensulfide dazu, sich in schwefel- und selenreiche Verbindungen umzulagern.[6]
1,2,3-Se3S5 kristallisiert als orangefarbene Kristalle in der monoklinen Raumgruppe P2/c (Raumgruppen-Nr. 13) mit den Einheitszellenparametern a = 855,0(5), b = 1 334,0(8), c = 933,6(4) pm und β = 124,17(5)° und mit vier Molekülen in der Einheitszelle.[7]
Herstellung
Die Selensulfide können direkt aus den Elementen Selen und Schwefel hergestellt werden:
Die durch Abkühlen der Schmelzen erhältlichen Selensulfide enthalten hauptsächlich achtgliederige Ringe (es sind 28 verschiedene SenS8-n-Molekülarten denkbar). Ihre Farbe ist bei geringem Selengehalt gelb (α-S8-Struktur bis 18 Gew.-% Se), bei mittleren Selengehalten orangegelb (γ-S8-Struktur bei 20–49 Gew.-% Se; α-S8-Struktur bei 50–68 Gew.-% Se) und bei hohem Selengehalt rubinrot. Mit steigendem Se-Gehalt sinkt der Schmelzpunkt der Gemische zunächst von 119,5 °C (S8) bis 105 °C (40 mol % Se) ab, um dann wieder anzusteigen.[6]
Ebenso entstehen sie durch Reaktion von Selen(IV)-oxid oder wässerige Selenige Säure mit Schwefelwasserstoff:[6]
1,2,3-Se3S5 kann durch Reaktion von Di-π-cyclo-pentadienyltitanpentasulfid mit Dichlordiselan dargestellt werden.[7]
Durch Reaktion von Sulfanen H2Sx oder des Pentasulfids Cp2TiS5 mit Diselenchlorid Se2Cl2 können gezielt Selensulfide bestimmter Zusammensetzung gewonnen werden (u. a. sechsgliederige Ringe: SeS5; 1,4-Se2S4; 1,2-Se4S2; Se5S; siebengliederige Ringe: 1,2-Se2S5; 1,2,5-Se3S4; 1,2-Se5S2; Se6S; achtgliederige Ringe: SeS7; 1,2,3-Se3S5; 1.2.5.6-Se4S4; 1,2-Se6S2; Se7S; zwölfgliederige Ringe: 1,2-/1,7-Se2S10). Die Strukturen der isolierten Selensulfide entsprechen dem Bau von Sn- bzw. Sen-Ringen gleicher Gliederzahl (Sessel-, Sessel-, Kronen- und dreistöckige Form im Falle der sechs-, sieben-, acht- und zwölfgliederigen Ringe). Im Falle der weniger symmetrischen siebengliederigen Ringe (entsprechendes gilt auch für zwölfgliederige Ringe) existieren Konformationsisomere, die sich rasch ineinander umwandeln, z. B. 1,2-Se5S2.[6]
Verwendung
Die Verbindungen werden auch in pharmazeutischen Formulierungen als Gemisch eingesetzt.
Selensulfide sind aufgrund ihrer fungiziden und gleichzeitig schuppenlösenden Wirkung eine häufige Komponente von Anti-Schuppen-Shampoos.[6] Diese enthalten meist 1 % des Wirkstoffs. In höherer Konzentration (2,5 %) sind Selensulfide in apothekenpflichtigen Pasten und Suspensionen zur Behandlung des seborrhoischen Ekzems enthalten. Höhere Konzentrationen sind verschreibungspflichtig. Da Selensulfide nicht resorbiert werden, besteht bei korrekter Anwendung der Präparate keine Vergiftungsgefahr. Selendisulfid hat in kosmetischen Produkten die Bezeichnung SELENIUM SULFIDE (INCI)[8].
Selensulfide werden auch als Reduktionsmittel in der Feuerwerkstechnik, als Inhibitor in der Polymerchemie, als Färbemittel in der Glasindustrie und zur Herstellung von photoelektrischen Zellen verwendet.[6]
Fiktion
In dem Film Evolution wurde Selen als Wirkstoff von Head & Shoulders erwähnt. Eine Gruppe von Akademikern versuchten mit Shampoo dieser Marke eine außerirdische Invasion zu stoppen, nachdem sie herausfanden, dass die außerirdische Lebensform empfindlich auf Selen reagiert. Faktisch ist im modernen Shampoo dieser Marke aber kein Selensulfid mehr enthalten und man nutzt stattdessen Pirocton-Olamin als schuppenreduzierende Komponente.[9]
Einzelnachweise
- Eintrag zu Selendisulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. September 2016. (JavaScript erforderlich)
- Externe Identifikatoren von bzw. Datenbank-Links zu Selenmonosulfid: CAS-Nummer: 7446-34-6, PubChem: 24011, ChemSpider: 32699978, Wikidata: Q27281354.
- Externe Identifikatoren von bzw. Datenbank-Links zu Diselenhexasulfid: CAS-Nummer: 75926-26-0, ChemSpider: 9296780, Wikidata: Q4119785.
- Ralf Steudel, Risto Laitinen: Cyclic selenium sulfides. In: Inorganic Ring Systems (=Topics in Current Chemistry. 102). Springer, Berlin / Heidelberg, 1982, ISBN 3-540-11345-2, S. 177–197, doi:10.1007/3-540-11345-2_11.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 626.
- Hollemann, Wiberg: Grundlagen und Hauptgruppenelemente. Walter de Gruyter GmbH & Co KG, 2016, ISBN 978-3-11-049585-0, S. 718 (eingeschränkte Vorschau in der Google-Buchsuche).
- Norbert Rautenberg, Jürgen Steidel, Ralf Steudel, Risto Laitinen: Crystal structure and vibrational analysis of Cyclo-Triselenium Pentasulfide prepared by the reaction of titanocene pentasulfide with dichlorodiselane. In: Zeitschrift für anorganische und allgemeine Chemie. Band 486, Nr. 1, 1982, ISSN 1521-3749, S. 116–128, doi:10.1002/zaac.19824860114 (wiley.com).
- Eintrag zu SELENIUM SULFIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Evolution (2001) Trivia


