Selenhexafluorid
Selenhexafluorid (SeF6) ist eine anorganische chemische Verbindung der Elemente Selen und Fluor. Selen liegt in seiner höchsten Oxidationsstufe +VI vor. Unter Normalbedingungen ist Selenhexafluorid ein farbloses, giftiges, leicht kondensierbares Gas.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
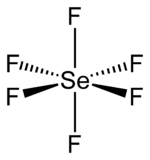 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Selenhexafluorid | |||||||||||||||
| Summenformel | SeF6 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 192,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
8,69 kg·m−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sublimationspunkt | ||||||||||||||||
| Löslichkeit |
unlöslich in Wasser (langsame Hydrolyse)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Ähnlich wie Schwefelhexafluorid lässt sich Selenhexafluorid aus den Elementen herstellen (Direktsynthese).
Eigenschaften
Physikalische Eigenschaften
Physikalisch interessant ist Selenhexafluorid durch seine in Gasform relativ hohe Dichte. Der Sublimationspunkt liegt bei Normaldruck bei −46,6 °C.[1] Unter Druck und im geschlossenen System zeigt die feste Substanz auch einen Schmelz- und Siedepunkt.[4] Seine kritische Temperatur liegt bei 72,4 °C, die Tripelpunkt-Temperatur bei −34,7 °C.[1]
Chemische Eigenschaften
Selenhexafluorid ist aufgrund seines symmetrischen, dichten Molekülbaus ähnlich reaktionsträge wie Schwefelhexafluorid, wenngleich thermisch etwas instabiler. Im Gegensatz zu seinem höheren Homologen Tellurhexafluorid wird es von Wasser nur sehr träge hydrolysiert, wobei Fluorwasserstoff und Selensäure entstehen. Bei erhöhter Temperatur reagiert die Verbindung mit Ammoniak zu explosivem Tetraselentetranitrid und Fluorwasserstoff.[5]
Verwendung
Selenhexafluorid wird als elektrischer Isolator in Bogenlampen-Elektroden und ähnlichem verwendet.[6]
Literatur
- Gmelins Handbuch der anorganischen Chemie, System Nr. 10, Selen, Teil B 2, S. 39–66.
Einzelnachweise
- Eintrag zu Selenhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Georg Kimmerle: Vergleichende Untersuchungen der Inhalationstoxicität von Schwefel-, Selen- und Tellurhexafluorid. In: Archiv für Toxikologie, 1960, 18 (2), S. 140–144; doi:10.1007/BF00605645.
- Eintrag zu Selenium hexafluoride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 628–629.
- L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Lithiumperoxid, CD-ROM Ausgabe 8/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4 .
- Agency for Toxic Substances and Disease Registry (ATSDR): ToxFAQs for Selenium Hexafluoride.


