Antimon(III,V)-oxid
Antimon(III,V)-oxid, auch Antimon(III)-antimonat(V) oder Diantimontetroxid, ist eine Antimonverbindung mit der Summenformel Sb2O4. Es gehört zur Stoffklasse der Oxide. Diantimontetroxid ist ein weißes, in der Hitze gelbes Pulver, das in Wasser unlöslich ist.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
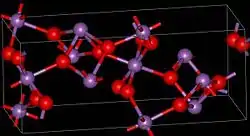 | ||||||||||||||||
| _ Sb3+/5+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Antimon(III,V)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Sb2O4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 307,51 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
In der Natur kommt Antimon(III,V)-oxid in Form des Minerals Cervantit vor. Fundstellen sind unter anderem in Rumänien, Bolivien und Spanien.[6]
Gewinnung und Darstellung
Antimon(III,V)-oxid bildet sind auf mehrere Weisen. Antimon(V)-oxid wandelt sich bei 800 °C unter Sauerstoffabgabe in Diantimontetroxid um. Dabei kommt es jedoch nicht zum Schmelzen der Verbindung.[7]
Auch aus Antimon(III)-oxid entsteht Diantimontetroxid, wenn es über 500 °C an der Luft erhitzt wird.[7]
Eigenschaften
In Antimon(III,V)-oxid sind keine vierwertigen Ionen vorhanden, vielmehr ist es ein Mischoxid von Antimon(III)- und Antimon(V)-oxid. Der häufig verwendete Name Antimon(IV)-oxid ist darum chemisch nicht ganz korrekt.
Es sind zwei Modifikationen, α- und β-Antimon(III,V)-oxid bekannt. Bei einer Temperatur von 1130 °C wandelt sich die α- in die β-Form um.[3] α-Antimon(III,V)-oxid kristallisiert im orthorhombischen Kristallsystem mit den Gitterparametern a = 5,43 Å, b = 4,81 Å und c = 11,78 Å sowie vier Formeleinheiten pro Elementarzelle. Die β-Form ist monoklin mit den Gitterparametern a = 12,06 Å, b = 4,84 Å, c = 5,38 Å und β = 104,56°, sowie vier Formeleinheiten pro Elementarzelle.[2]
Es liegen dabei Schichten aus SbO5-Oktaedern vor, die ein fünfwertiges Antimonatom im Zentrum besitzen. Dies sind über ihre Ecken miteinander verknüpft. Die Schichten sind untereinander über die dreiwertigen Antimonatome verknüpft.[7]
Löslich ist Diantimontetroxid in konzentrierter Schwefelsäure und Salzsäure. Dagegen löst sich die Verbindung nicht in Wasser und verdünnten Säuren und Laugen.[3]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 820.
- J. Amador, E. Gutierrez Puebla, M. A. Monge, I. Rasines, C. Ruiz Valero: Diantimony Tetraoxides Revisited, in: Inorg. Chem. 1988, 27, 1367–1370, doi:10.1021/ic00281a011.
- Eintrag zu Antimonoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Strem Chemicals: Antimony(IV) oxide (99.99%-Sb) PURATREM, abgerufen am 27. Dezember 2019.
- M. Binnewies, E. Milke: Thermochemical Data of Elements and Compunds. 2. Auflage. Wiley-VCH, Weinheim 2002, ISBN 3-527-30524-6, S. 829.
- Paul Ramdohr, Hugo Strunz: Lehrbuch der Mineralogie. 16. Auflage. Ferdinand Enke Verlag 1978, ISBN 3-432-82986-8 (S. 543).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 849.

