Antimon(III)-chlorid
Antimon(III)-chlorid (SbCl3) ist eine chemische Verbindung bestehend aus den Elementen Antimon und Chlor. Es gehört zur Stoffklasse der Chloride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Sb3+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Antimon(III)-chlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | SbCl3 | |||||||||||||||
| Kurzbeschreibung |
farblose, hygroskopische, weiche Masse mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 228,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,14 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
223 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Antimon(III)-chlorid wurde zuerst von Johann Rudolph Glauber im 17. Jahrhundert dargestellt.
Gewinnung und Darstellung
Antimon(III)-chlorid kann durch Reaktion von Antimon oder Antimon(III)-oxid mit konzentrierter Salzsäure gewonnen werden.[2]
Ebenfalls möglich ist die Darstellung aus den Elementen.[5]
Bei Paracelsus (16. Jahrhundert) finden sich Anweisungen zur Herstellung von Antimonbutter, etwa aus Antimontrisulfid und Quecksilberchlorid.[6]
Eigenschaften
Physikalische Eigenschaften
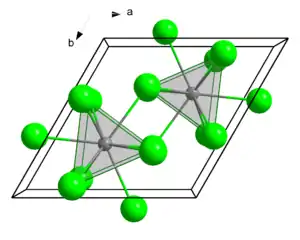
Antimon(III)-chlorid kristallisiert in einer verzerrten Uran(III)-chlorid-Struktur. Es liegt in Form einer farblosen weichen Masse mit stechendem Geruch vor, welche an feuchter Luft raucht. Die Dämpfe von Antimon(III)-chlorid sind achtmal so schwer wie Luft.
Chemische Eigenschaften
Antimon(III)-chlorid ist leicht löslich in Wasser, hydrolysiert jedoch heftig bei Zugabe größerer Mengen Wasser, wobei Antimon(III)-oxidchlorid[2] und Chlorwasserstoff entstehen.
Verwendung
Antimon(III)-chlorid wird als Reagenz zum Nachweis von Vitamin A und anderen Carotinoiden beim Carr-Price-Test verwendet, wobei eine blaue Komplexverbindung entsteht, die durch Kolorimetrie gemessen werden kann. Es dient weiterhin als Katalysator für Polymerisations- und Chlorierungsreaktionen in der organischen Chemie, bei der Herstellung von Flammschutzmitteln, Pigmenten und anderen Antimonverbindungen. Weiterhin wurde die Verbindung früher Absinth zugesetzt, um künstlich eine milchige Trübung des Getränks hervorzurufen.
Sicherheitshinweise
Die Befunde zur Gentoxizität den Antimon(III)-chlorid sind nicht einheitlich. Insgesamt scheint die Verbindung, zumindest in vivo, gentoxisch zu wirken.[2]
Antimon(III)-chlorid wurde 2018 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Antimon(III)-chlorid waren die Besorgnisse bezüglich der möglichen Gefahren durch krebsauslösende und reproduktionstoxische Eigenschaften. Die Neubewertung fand ab 2018 statt und wurde von Deutschland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[7][8]
Trivia
In der TV-Serie Der Doktor und das liebe Vieh (Staffel 3, Folge 12) verenden mehrere Kälber durch eine rätselhafte Vergiftung, bis sich herausstellt, dass ihre Hornansätze kurz zuvor mit Antimontrichlorid weggeätzt worden waren. Die entstandenen antimonhaltigen Krusten fielen in das Futter und wurden mitgefressen.
Einzelnachweise
- Eintrag zu Antimon(III)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Toxikologische Bewertung von Antimon(III)-chlorid (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.
- Eintrag zu Antimony trichloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 952 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 588.
- Friedrich Dobler: Die chemische Fundierung der Heilkunde durch Theophrastus Paracelsus: Experimentelle Überprüfung seiner Antimonpräparate. In: Veröffentlichungen der Internationalen Gesellschaft für Geschichte der Pharmazie, Neue Folge, 10, 1957, S. 76–86, hier: S. 82 f.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Antimony trichloride, abgerufen am 1. Mai 2020.

