Antimon(III)-sulfid
Antimon(III)-sulfid, genannt auch Schwefelantimon, ist eine chemische Verbindung der Elemente Antimon und Schwefel. Es gehört zu der Gruppe der Sulfide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
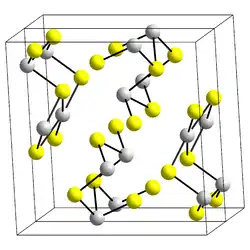 | ||||||||||||||||
| _ Sb3+ _ S2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Antimon(III)-sulfid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Sb2S3 | |||||||||||||||
| Kurzbeschreibung |
dunkelgrau bis schwarz (kristalline form) orangerot (amorph)er geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 339,68 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,12–4,64 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1150 °C[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Antimon(III)-sulfid kommt natürlich in Form des Minerals Stibnit (Grauspießglanz) vor. Zur Gewinnung von reinem Antimon(III)-sulfid werden Grauspießglanzerze mit größeren Anteilen an mineralischen Beiprodukten (Gangart) vor der Verarbeitung zunächst so weit erhitzt, dass die relativ niedrig schmelzende Verbindung, auf schräger Fläche abfließt (Seigerarbeit). Das ausgeseigerte Produkt mit einem Gehalt von 92 % bis 98 % Antimon(III)-sulfid wird als antimonium crudum bezeichnet.[4]
Gewinnung und Darstellung
Reines Antimon(III)-sulfid kann durch Reaktion von Antimon(III)-chlorid mit Thioacetamid in Ethanol[5] oder in Eisessig[6] hergestellt werden.
Antimon(III)-sulfid kann auch durch Zusammenschmelzen der Elemente[7]
oder durch Einleiten von Schwefelwasserstoff in angesäuerte Lösungen von drei- oder fünfwertigen Antimonverbindungen gewonnen werden.[7]
Eigenschaften
Antimon(III)-sulfid ist ein dunkelgrau bis schwarzer (kristalline Form) oder orangeroter (amorphe Form) geruchloser Feststoff, welcher praktisch unlöslich in Wasser ist.[1] Die bei Fällungsreaktionen erhaltene orangerote Form wandelt sich beim Erhitzen unter Luftabschluss (unter Stickstoff ab 270 °C) in die stabilere graue Version um.[7] An Luft erfolgt eine Zersetzung zu Antimon(III)-oxid schon ab Temperaturen über 300 °C.[8] In kochendem Wasser oder bei Kontakt mit Wasserdampf[1] zersetzt es sich langsam unter Bildung von Schwefelwasserstoff.[9]
Antimon(III)-sulfid ist in heißem Ammoniakwasser wenig löslich, in starken Säuren und -Laugen löslich und bildet mit kochender Salzsäure Antimon(III)-chlorid.[4]
Mit verdünnter Salpetersäure bildet es Antimon(III)-oxid, mit konzentrierter Antimonsäure[7].
Antimon(III)-sulfid kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 1131,07 pm, b = 383,63 pm und c = 1122,85 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[10]
Verwendung
Antimon(III)-sulfid wurde früher unter dem Namen Antimonschwarz als Pigment verwendet. Das im Mittelalter antimonium und „Spießglas“[11] genannte Mineral ist bereits seit der Antike bekannt und wurde als schwarzer Schminkpuder zum Färben von Augenlidern und Augenbrauen verwendet (aber auch zur Behandlung von Hämorrhoiden[12]). Heute wird die Verbindung noch in der Pyrotechnik, rubinrotem Glas, als Farbstoff für Kunststoffe und als Flammschutzmittel verwendet.[7]
Es reagiert mit Kaliumchlorat und war ca. 1826 Bestandteil des ersten echten Streichholzes mit Reibungszündung von John Walker:[13][14]
Heutzutage wird es in der Streichholzherstellung nicht mehr in Zündköpfen, sondern nur noch selten in Reibflächen für Sicherheitsstreichhölzer verwendet.[14]
Antimon(III)-sulfid ist ein Halbleiter mit hoher Photosensitivität, der in Fernsehkameras und verschiedenen optoelektronischen Geräten eingesetzt wurde.[5]
Es kann auch zur Herstellung von Antimon durch Reaktion mit Eisen[4]
oder Sauerstoff und Kohlenstoff verwendet werden.[4]
Da Antimon(III)-sulfid infrarotes Licht ähnlich wie Grünpflanzen reflektiert, ist es in vielen Tarnfarben enthalten.[15]
Sicherheitshinweise
Aussagefähige Tests der akuten oralen Toxizität liegen für Antimon(III)-sulfid nicht vor. Aus dem beruflichen Umgang ist jedoch nicht über akute lokale oder systemische Wirkungen der Verbindung berichtet worden. In einer Feldstudie an Arbeitern, die über längere Zeit Antimon(III)-sulfid-Staub (resultierend aus Mahlprozessen) inhalierten, zeigten die Betroffenen keine gesundheitlichen Beeinträchtigungen. Bei einer zweiten Studie, bei der Arbeiter in der Schleifmittelherstellung längere Zeit Antimon(III)-sulfid-Staub ausgesetzt waren, wurde eine erhöhte Mortalitätsrate infolge von Herzerkrankungen auffällig. Aus Tierversuchen mit sulfidischen Antimonerzen gibt es Hinweise, die eine kanzerogene Wirkung nicht ausschließen. Eine Risikoabschätzung für den Menschen lässt die verfügbare Datenbasis jedoch nicht zu.[1]
Antimon(III)-sulfid wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Antimon(III)-sulfid waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR), anderer Exposition/risikobasierter Bedenken und weit verbreiteter Verwendung sowie der möglichen Gefahr durch krebsauslösende Eigenschaften. Die Neubewertung läuft seit 2018 und wird von Deutschland durchgeführt.[16]
Einzelnachweise
- Eintrag zu CAS-Nr. 1345-04-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. November 2012. (JavaScript erforderlich)
- Datenblatt Antimon(III)-sulfid bei Sigma-Aldrich, abgerufen am 10. November 2012 (PDF).
- M. Binnewies, E. Milke: Thermochemical Data of Elements and Compounds. 2. Auflage. Wiley-VCH, Weinheim 2002, ISBN 3-527-30524-6, S. 828.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 817.
- B. Cheng, E. T. Samulski: "One-step, ambient-temperature synthesis of antimony sulfide (Sb2S3) micron-size polycrystals with a spherical morphology", in: Materials Research Bulletin, 2003, 38, S. 297–301; Volltext (Memento vom 7. September 2006 im Internet Archive) (PDF; 196 kB)
- R. S. Mane, B. R. Sankapal, C. D. Lokhande: "Non-aqueous chemical bath deposition of Sb2S3 thin films", in: Thin Solid Films, 1999, 353 (1), S. 29–32; doi:10.1016/S0040-6090(99)00362-4.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Aero Propulsion and Power Lab: Thermal Analysis Study of Antimony Sulfides, Charles K. Kelley, Juli 1989
- Ronald Rich: Inorganic Reactions in Water. Springer, 2007, ISBN 3-540-73962-9, S. 398 (eingeschränkte Vorschau in der Google-Buchsuche).
- P. Bayliss, W. Nowacki: "Refinement of the crystal structure of stibnite, Sb2S3", in: Zeitschrift für Kristallographie, 1972, 135, S. 308–315; Volltext (PDF; 312 kB).
- Vgl. etwa Ute Obhof: Rezeptionszeugnisse des „Gart der Gesundheit“ von Johann Wonnecke in der Martinus-Bibliothek in Mainz – ein wegweisender Druck von Peter Schöffer. In: Medizinhistorische Mitteilungen. Zeitschrift für Wissenschaftsgeschichte und Fachprosaforschung. Band 36/37, 2017/2018, S. 25–38, hier: S. 34 (Antimonium „spieszglasz“).
- Konrad Goehl: Beobachtungen und Ergänzungen zum ‘Circa instans’. In: Medizinhistorische Mitteilungen. Zeitschrift für Wissenschaftsgeschichte und Fachprosaforschung. Band 34, 2015 (2016), S. 69–77, hier: S. 71.
- Peter Paetzold: Chemie: Eine Einführung. Walter de Gruyter, 2009, ISBN 3-11-020268-9, S. 770 (eingeschränkte Vorschau in der Google-Buchsuche).
- Alexander P. Hardt: Pyrotechnics, Pyrotechnica Publications, Post Falls Idaho USA 2001, ISBN 0-929388-06-2, S. 74 ff.
- Eintrag zu Antimonsulfide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Mai 2014.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Antimony sulphide, abgerufen am 26. März 2019.

