Leishmaniose
Leishmaniose oder Leishmaniase (fachsprachlich auch lateinisch Leishmaniosis und Leishmaniasis) ist eine weltweit bei Mensch und Tier vorkommende Infektionserkrankung, die durch obligat intrazelluläre protozoische Parasiten der Gattung Leishmania hervorgerufen wird. Ihr Verbreitungsgebiet sind die Tropen, besonders Peru, Kolumbien und das östliche Afrika, aber auch der Mittelmeerraum und Asien. Seit Mitte der 1980er Jahre treten die Sandmücken, welche die Leishmaniose übertragen, möglicherweise durch Klimawandel, auch zunehmend in Deutschland auf.[1] Es gibt in Deutschland verstärkt Fälle von Leishmaniose bei Tieren und vereinzelt auch bei Menschen, die Deutschland nie verlassen haben.[2]
Entdeckt wurde der Krankheitserreger Leishmania donovani 1900 von William B. Leishman und Charles Donovan.[3]
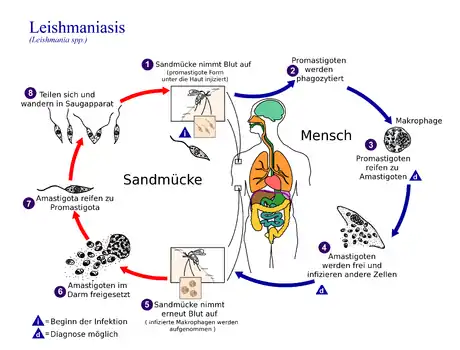
Übertragung
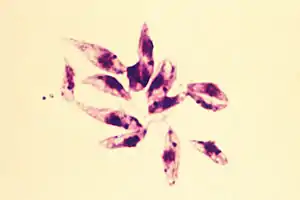
Sandmücken (aus der Familie der Schmetterlingsmücken) übertragen die Infektion. In den 1950er-Jahren dezimierte der Einsatz von Insektiziden (hauptsächlich DDT) gegen malariaübertragende Anophelesmücken auch die Sandmücken (Phlebotominae) stark. Inzwischen haben sich die Sandmückenpopulationen wieder auf das ursprüngliche Niveau vermehrt, sodass im Mittelmeerraum die Zahlen der Leishmaniose-Erkrankungen von Mensch und Tier zunehmen.
Die zunehmende Ausbreitung der Sandmücke in Richtung Norden wird mit der globalen Erwärmung sowie der zunehmenden Globalisierung in Verbindung gebracht.[4] Das zur Goethe-Universität Frankfurt und der Senckenberg-Gesellschaft für Naturforschung gehörende Biodiversität- und Klima-Forschungszentrum (BiK-F) hat im Sommer 2014 bei Gießen anhand einer Sandmücke der Art Phlebotomus mascittii den bisher nördlichsten Nachweis einer Sandmücke geführt.[5]
Leishmaniose ist in 98 Staaten endemisch und verursacht jährlich etwa 1 Million kutane Infektionen und 50.000 bis 90.000 viszerale Infektionen.[6]
Die Infektionsrate von Hunden mit Leishmaniose ist insbesondere im Mittelmeerraum stellenweise sehr hoch: In Andalusien sind bis zu 42 % der Hunde infiziert, auf Sizilien bis zu 80 %. Die Infektionsrate bei Menschen und Hunden hängt von der lokalen Sandmückenpopulation, deren Durchseuchung und Stechgewohnheiten ab.
Formen der menschlichen Leishmaniose
| Klassifikation nach ICD-10 | |
|---|---|
| B55.- | Leishmaniose |
| B55.0 | Viszerale Leishmaniose |
| B55.1 | Kutane Leishmaniose |
| B55.2 | Mukokutane Leishmaniose |
| B55.9 | Leishmaniose, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Es gibt viele Krankheitsbilder, die der geografischen Verbreitung der jeweiligen Leishmania-Arten zuzuordnen sind. Sie reichen vom lokal begrenzten, oft spontan ausheilenden Solitärulkus bis zur tödlich endenden Allgemeinerkrankung. Weltweit unterscheidet man drei Leishmanioseformen.
Innere Leishmaniose (viszerale Leishmaniose)
Bei der inneren Leishmaniose oder viszeralen Leishmaniose (auch Dum-Dum-Fieber, Schwarzes Fieber oder Kala-Azar) sind die inneren Organe (lateinisch viscera: Eingeweide) befallen. Es kommt zu einer eine Leberschwellung begleitenden Milzschwellung (tropische Splenomegalie).[7] Die Erreger sind Leishmania donovani (die von Leishman und Donovan entdeckte Flagellatenart), in Europa Leishmania infantum. Diese Erkrankung hat sich vermutlich ursprünglich von Ostafrika über den vorderen Orient bis nach Indien ausgebreitet.[8][9][10][11]
Paläomediziner um Albert R. Zink konnten in altägyptischen Mumien erst ab dem Mittleren Reich die mitochondriale DNA von Leishmania donovani nachweisen.[12] Die innere Leishmaniose wurde früher auch als Ponos (bei Hippokrates Πόνος) und „Rippkuchen“ bezeichnet.[13]
1977 wurde in Indien (Nordbihar) eine große Epidemie mit ca. 70.000 erkrankten Personen beobachtet. Der Begriff Kala-Azar stammt aus dem Hindi, bezieht sich auf die braunschwarze Pigmentierung der trockenen Haut bei dieser Erkrankung, und bedeutet „schwarze Krankheit“[14] oder „schwarze Haut“. Die viszerale Leishmaniose ist allerdings nicht auf Indien und China beschränkt. Sie tritt auch in Europa auf, z. B. im Mittelmeerraum von Portugal bis in die Türkei, und ist auch in Südamerika (dort besonders in Brasilien) vertreten.
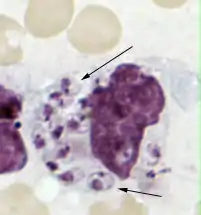
In der Histologie sind die typisch schiffchenförmigen Leishmanien in einem Makrophagen zu erkennen. Ohne Therapie enden ca. 95 % der Krankheitsfälle tödlich.[15] Als erstes orales Therapeutikum wurde im Dezember 2004 in Deutschland der Wirkstoff Miltefosin zugelassen.
Hautleishmaniose (kutane Leishmaniose)
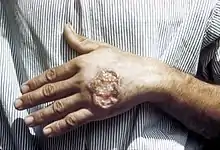
Die kutane Leishmaniose (auch bekannt als Hautleishmaniosis, Bagdadbeule, Orientbeule und Aleppobeule) befällt im Gegensatz zur viszeralen Leishmaniose lediglich die Haut (lateinisch cutis) und verschont die inneren Organe. Die übertragenden Sand- bzw. Schmetterlingsmücken nehmen bei einer Blutmahlzeit die Leishmanien auf; diese machen im Darm der Mücken einen Entwicklungszyklus durch und gelangen später in den Stechrüssel. Infizierte Mücken geben sie beim Stich weiter. Die Erreger sind L. tropica major, L. tropica minor, L. tropica infantum und L. aethiopica.
Nach dem Stich der Sandmücke kommt es zunächst zu einer Rötung, danach entwickeln sich juckende Knötchen auf der Haut, die sich in Papeln umwandeln und ein nicht schmerzhaftes Geschwür bilden. Die Größe der Geschwüre liegt meist zwischen einem und fünf Zentimetern. Die Vermehrung der Parasiten ist häufig auf den Ort der Infektion beschränkt. Oft ist das Gesicht betroffen. Klinisch sind die feuchte (L. tropica major), die trockene (L. tropica minor) und die diffuse (L. tropica infantum und L. tropica aethiopica) Leishmaniose zu unterscheiden.
Von einer Therapie der erstgenannten beiden Formen wird meist abgesehen, da die sich entwickelnde Beule nach einem halben bis einem Jahr von selbst abheilt. Die Narben sind häufig entstellend. Die diffuse Hautleishmaniose heilt ohne Behandlung nicht aus.
Zur systemischen Therapie ist unter anderem Miltefosin in Deutschland verfügbar, daneben wird Paromomycin als intramuskuläre Injektion angewandt. Die Therapie mit cortisolhaltigen Salben ist kontraindiziert (nicht empfohlen). Hingegen zeigte eine tunesisch-amerikanische randomisierte placebokontrollierte Phase-3-Doppelblindstudie 2013 mit 375 Patienten, dass eine Salbe mit 15 % Paromomycin über zwanzig Tage einmal täglich aufgetragen signifikant besser als die Placebosalbe wirkte und nach 98 Tagen eine Heilung in 81 % zeigte, im Vergleich zu 58 % in der Placebogruppe und 82 % mit einer Salbe mit 15 % Paromomycin und zusätzlich 0,5 % Gentamicin, das somit keinen zusätzlichen Effekt brachte. Im Gegensatz zur intramuskulären Paromomycin-Therapie ergaben sich keine klinisch bedeutsamen nieren- oder gehörtoxischen Nebenwirkungen, die systemische Exposition war durch die Salbenapplikation auf 10 % reduziert. Lokal wurden in den ersten Tagen nach Therapiebeginn vermehrt milde bis mittelgradige entzündliche (6 %) und Bläschenreaktionen (26 %) im Bereich der Hautläsionen beobachtet, jedoch keine Superinfektionen (die in der Placebogruppe in 10 % auftraten).[16]
Schleimhautleishmaniose (mukokutane Leishmaniose)
Die mukokutane Leishmaniose ist unter verschiedenen Namen (u. a. Uta oder Espundia) in Südamerika bekannt. Sie befällt neben der Haut auch die Schleimhaut (lateinisch mucus: Schleim). Der Erreger ist L. brasiliensis und wird ebenfalls durch die Schmetterlingsmücke übertragen. Klinisch zeigt sich eine schwer verlaufende, destruierende Hautläsion, die nicht spontan abheilt.
Veterinärmedizin
Leishmaniose kommt im Bereich der Haustiere bevorzugt beim Haushund vor. Sie gehört zu den durch Vektoren übertragenen Krankheiten (Companion Vector-borne Diseases, CVBD). Für Katzen, Nager, Rinder und Hauspferd existieren ebenfalls Beschreibungen der Erkrankung. Die Leishmaniose der Meerschweinchen wird durch den wirtsspezifischen Erreger Leishmania enriettii verursacht und tritt nur in Südamerika auf.
Ätiologie
Hunde und Nager scheinen das Hauptreservoir des Erregers zu sein. Die Übertragung auf Menschen oder andere Säugetiere entspricht wahrscheinlich nicht dem ursprünglichen Wirtsspektrum der Leishmanien. Zur Entwicklung benötigt der Parasit zwei Wirte. Zum einen handelt es sich hierbei um ein Stechinsekt (Phlebotomus sp. oder Lutzomyia sp.), in dessen Blut sich die etwa 10 bis 15 µm (Mikrometer) lange, begeißelte und promastigote Form entwickelt und vermehrt. Wirbeltiere einschließlich des Menschen tragen dagegen die mit 2 bis 5 µm Länge wesentlich kürzere amastigote (unbegeißelte) Form in sich, welche sich bevorzugt im Zellinneren von Makrophagen – besonders im Bereich des retikuloendothelialen Systems – ansiedeln. Dies gelingt ihnen aufgrund ihrer Fähigkeit, den Säuregehalt der Phagosomen zu neutralisieren und freie Sauerstoffradikale im Makrophageninneren abzufangen. Hier findet auch ihre Vermehrung durch Zellteilung statt.
Die Einteilung der Parasiten erfolgt anhand ihrer Morphologie, des bewirtenden Insektes, der Art der ausgelösten Krankheitssymptome und serologischen Tests. Daneben werden Zymodeme nach der Ähnlichkeit der im Parasiten aktiven Enzyme sowie Schizodeme nach speziellen DNA-Fragment-Mustern (RFLP-Mustern) auf den Kinetoplasten unterschieden.
Pathogenese
Im Darm des übertragenden Vektors kommt es nach dem Saugen infizierten Blutes zu einer starken Vermehrung der noch unbegeißelten Form, welche sich anschließend zum größeren, geißeltragenden Parasiten transformiert. Mittels dieser Geißeln wandern die Leishmanien aktiv in den Stechrüssel des Insektes ein und werden von dort bei dessen nächster Blutmahlzeit in das Gewebe des Säugers übertragen. Sie werden von dendritischen Zellen der Haut und lokalen Makrophagen aufgenommen und vermehren sich in deren Innerem. Nach ihrer Vermehrung zerstören die Parasiten die Zellmembran und werden so wiederum im Organismus freigesetzt, woraufhin sie neuerlich Zellen des Abwehrsystems des Körpers befallen. Hauptsächlich findet dieses in Lymphknoten, Knochenmark, Milz und Leber statt. Die Inkubationszeit ist dabei sehr unterschiedlich und kann zwischen einem Monat und sieben Jahren betragen.
Entsprechend der Immunantwort des Wirtes wird der weitere Krankheitsverlauf bestimmt. Resistente Tiere reagieren auf die Infektion mit einer zellvermittelten Immunantwort über T1-Helferzellen. Überwiegt hingegen eine humorale Immunantwort, werden die trotz der Anheftung von Antikörpern weiterhin infektionsfähigen Erreger wiederum von Makrophagen aufgenommen und die Infektion breitet sich aus. Mit zunehmender Dauer der Erkrankung wird die Immunantwort immer unspezifischer, was durch ein Übermaß an zirkulierenden Antigen-Antikörper-Komplexen letztlich zur Ausbildung von Symptomkomplexen wie der viszeralen Form, des Nierenversagens oder zum Tod führen kann. Neben dieser indirekten Schädigung bewirkt der Parasit aber auch unmittelbare Schädigungen, die sich in granulomatösen Entzündungen von Haut, Leber, Niere, Darm, Augen und Knochen äußern können.
Bei Katzen ist die Leishmaniose sehr häufig mit Krankheiten, die das Immunsystem schädigen, vergesellschaftet, vor allem mit dem Immundefizienzsyndrom der Katzen.[17]
Klinik, Diagnostik

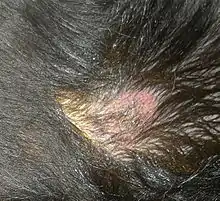

Infolge der Tatsache, dass Leishmanien nahezu alle Organsysteme des Körpers befallen können, kann sich die Krankheit sehr vielfältig darstellen. Einem Großteil der erkrankten Hunde ist jedoch das Auftreten von Störungen der Haut gemein. Anhand der Verteilung dieser Störung können Rückschlüsse auf die Prognose der Erkrankung gezogen werden:
- Symmetrischer Haarverlust und Schuppenbildung: mit 60 % der Fälle häufigstes Krankheitsbild, das vorwiegend Tiere mit intaktem Immunsystem entwickeln; beginnend am Kopf verbreitet sich die Erkrankung am gesamten restlichen Körper (sekundäre Sebadenitis).[18]
- Hautgeschwüre über Knochenvorsprüngen, an Schwanzspitze und Ohren und im Haut-Schleimhaut-Übergang: betrifft 20 % der befallenen Tiere und deutet auf eine geschwächte Immunabwehr hin. Die Symptome werden einerseits direkt durch die Parasiten hervorgerufen, können aber auch indirekt über eine von Immunkomplexen hervorgerufene Vaskulitis verursacht werden.
- Knötchenbildung in der Haut: In die Haut eingewanderte Makrophagen führen zur Ausbildung der Knötchen; weitere Abwehrzellen sind nur geringfügig beteiligt. Die Erkrankung tritt bei etwa 12 % der Patienten auf und weist auf eine ungenügende Immunabwehr hin.
- Generalisierte Hautdegeneration mit Pustelbildung im Bereich des Körperstammes: mit 4 % die seltenste Form. Die Pusteln sind mit einer nichteitrigen Flüssigkeit und einigen Parasiten gefüllt. Die Pathogenese dieser Form ist nicht geklärt und es gibt keinen Hinweis auf einen Zusammenhang mit der Immunkompetenz des erkrankten Tieres.
- Re- oder intermittierendes Fieber mit zwei Spitzen pro Tag (doppelgipfliges Fieber) ist ein Hinweis auf eine viszerale Leishmaniose.
Neben den beschriebenen Störungen kann die Haut weitere Symptome wie übermäßige Verhornung, Krallenverkrümmung, Nagelbettentzündung und Pigmentverlust im Nasen-Maulbereich ausbilden. Auch die Schleimhäute können betroffen sein.
Bei Katzen dominieren geschwürige und knotige Hautveränderungen das klinische Bild. Sie treten in 3/4 der Fälle auf. Bei über einem Drittel der erkrankten Katzen kommt es zu Augenerkrankungen, Anämien und Nierenschädigungen.[17]
Neben der Erkrankung der Haut sind häufig gleichfalls die inneren Organe betroffen (viszerale Leishmaniose). Je nach Organbeteiligung ist die Ausbildung von Leberentzündungen, Darmentzündungen, Nierenversagen, Blutgefäßentzündungen, Knochenmarkentzündungen, Gelenkentzündungen, Nervenentzündungen und Muskelentzündungen möglich.
Infolge des sich ausgesprochen vielfältig darstellenden Krankheitsbildes kann die Diagnosefindung schwierig sein, zumal die Krankheit in den meisten Teilen Deutschlands nicht endemisch ist und daher oft nicht zur Routinediagnostik gehört. Zudem besteht kein sicherer Test für die Krankheit.
Die Diagnosestellung beruht neben dem direkten Parasitennachweis vor allem auf Untersuchungen zur Immunantwort des Wirtes. Ein direkter Nachweis der Leishmanien kann mittels zytologischer oder histologischer Untersuchungen erfolgen, bei welchen Zellen des Knochenmarks, der Lymphknoten oder der Haut mikroskopisch untersucht werden, was eine direkte Identifizierung der sich meist intrazellulär befindenden Leishmanien ermöglicht. Als weitere Untersuchung bietet sich als gentechnische Methode die PCR an, welche bei Proben aus dem Knochenmark eine Sensitivität und Spezifität von fast 100 Prozent aufweist.
Unter den indirekten Nachweisverfahren hat die serologische Bestimmung von Antikörpern mittels Immunfluoreszenz-Test oder ELISA die weiteste Verbreitung gefunden. Obwohl auch hier Sensitivität und Spezifität mit etwa 80 Prozent recht hoch sind, können falsch negative Ergebnisse bei frisch infizierten Tieren, welche noch keine Antikörper entwickelt haben, auftreten. Dieses Problem besteht gleichfalls beim Intrakutantest, der aber unter Umständen eine Aussage über die Schwere des Krankheitsverlaufes ermöglicht. Ferner besteht die Möglichkeit eines Stimulationstests der mononukleären Zellen des Blutes.
Therapie der viszeralen Leishmaniose
Häufig ist eine vollständige Heilung der Erkrankung nicht möglich. Die therapeutischen Ansätze konzentrieren sich daher – neben der Erregerelimination – vor allem auf eine Stärkung der körpereigenen zellulären Abwehr.
Pentamidin
Pentamidin ist Ende der 1930er Jahre in Großbritannien als Mittel gegen die Schlafkrankheit entwickelt worden. Trotz häufiger Nebenwirkungen hat es nach wie vor seinen Platz in der Therapie der Leishmaniose.[19] Es wird als 2. Wahl-Therapie statt Amphotericin B (vorzugsweise L-AmB) intravenös verabreicht.[20]
N-Methylglucamin-Antimonat
N-Methylglucamin-Antimonat (Handelsname Glucantime[21]) gilt derzeit als Mittel der Wahl in der Behandlung der Leishmaniose. Durch das Medikament werden im Parasiten ablaufende Glykolyse- und Fettsäureabbauvorgänge gehemmt. Die abgestorbenen Leishmanien stimulieren ihrerseits die zelluläre Abwehr. Das Medikament wird nicht im Darm resorbiert und wird daher per Injektion an 20 bis 30 aufeinanderfolgenden Tagen verabreicht. Als Nebenwirkungen sind schmerzhafte Schwellungen im Bereich der Injektion beschrieben, außerdem kann es zur Ausbildung von Magen-Darm-Beschwerden kommen.
Natriumstibogluconat
Natriumstibogluconat (Handelsname: Pentostam) kann (als 2. Wahl-Therapie statt Amphotericin B[22]) bei allen Formen der menschlichen Leishmaniose eingesetzt werden. Seine Wirkung beruht auf dem Abtöten der Amastigoten, der zugrunde liegende molekulare Prozess ist aber noch unbekannt. Die empfohlene Dosierung liegt bei täglich 20 mg Sb pro kg Körpergewicht (NSG enthält 100 mg Sb/ml) über eine Behandlungsdauer von 28 Tagen hinweg, wobei die Injektion intravenös oder intramuskulär erfolgen kann. Nebenwirkungen können unter anderem Übelkeit, Kopfschmerzen, Erbrechen, Arthralgien, Myalgien und Anorexie sein. Die intramuskuläre Injektion ist darüber hinaus sehr schmerzhaft.[23] Bei schweren Nieren-, Herz- und Lebererkrankungen darf NGS nicht verwendet werden.
Miltefosin
Miltefosin (Handelsname Impavido[24]), welches als 2. Wahl-Therapie statt Liposomalem Amphotericin B[25] eingesetzt wird, hat sich in Studien als wirksam gegen Leishmanien gezeigt. Miltefosin ist in Deutschland zur Behandlung der Leishmaniose des Menschen zugelassen, für Hunde in Südeuropa und in der Schweiz.
Allopurinol
Der aus der Therapie der Gicht bekannte Wirkstoff Allopurinol hemmt die Synthese von Purinen im Wirtsorganismus. Da Leishmanien nicht in der Lage sind, diese Purine selbst herzustellen, und daher auf eine Versorgung über den Wirt angewiesen sind, werden sie in ihrer Entwicklung gehemmt. Die Verabreichung erfolgt oral und wird meist mit einem anderen Medikament kombiniert, da Allopurinol lediglich parasitostatisch wirkt.
Antibiotika
Bei Auftreten von Resistenzen gegen eine Kombinationstherapie oder einen der oben genannten Wirkstoffe besteht die Möglichkeit des Einsatzes der Antimykotika und Antibiotika (Liposomales) Amphotericin B (auch als Mittel 1. Wahl[26]) oder Aminosidin.
Vom Institute for OneWorld Health wurde das Aminoglykosid-Antibiotikum Paromomycin in klinischen Studien erfolgreich gegen viszerale Leishmaniose getestet. In Indien liegt für diese Indikation inzwischen eine Zulassung vor.
Weitere Wirkstoffe
Fallberichte schildern den erfolgreichen Einsatz der Antimykotika Ketoconazol und Amphotericin B in Lipidform sowie des Anthelmintikums Levamisol, der von Studien bisher aber nicht bestätigt wurde.
Beim Hund konnte in einer Studie mit einer einmonatigen Gabe von Domperidon eine klinische Verbesserung, eine Verbesserung der zellulären Immunität und bei vielen Tieren auch eine Verminderung der Antikörper-Titer erzielt werden.[27]
Immuntherapie
Zur Stärkung der körpereigenen Abwehr kann der Einsatz von rekombinatem Interferon eine therapeutische Option sein, da hierbei die Differenzierung von Lymphozyten zu T1-Helferzellen gefördert wird.
Prophylaxe
Ein wesentlicher Bestandteil der Bekämpfung der Leishmaniose ist die Prophylaxe einer Infektion. Der klassische Weg ist hierbei, den Vektor (Krankheitsüberträger) vom Stich am Wirt abzuhalten (Repellenzwirkung). Gute Erfolge werden hierbei mit Pyrethroiden wie Permethrin oder Deltamethrin erzielt.
Seit dem 14. März 2011 ist europaweit der Impfstoff Canileish zugelassen, der bei Hunden, die negativ auf Leishmanien getestet wurden, das Risiko einer Infektion und Erkrankung nach dem Kontakt mit Leishmanien verringern soll.[28] Seit 2019 gibt es mit LetiFend einen weiteren Impfstoff, der mit einer einmaligen Anwendung einen einjährigen Schutz verspricht.
Forschung
Der britische Parasitologe Ralph Lainson machte in den 1960er Jahren zunächst im damaligen British Honduras (heute Belize) und später an der Wellcome Trust Parasitology Unit im Evandro Chagas Institute in Belém, Brasilien, zahlreiche Entdeckungen, die wesentlich zum Verständnis der Leishmaniose beitrugen. Der 1987 entdeckte Leishmania (Viannia) lainsoni wurde nach ihm benannt.[29]
Seit dem 7. September 2011 gibt es das World-Community-Grid-Projekt Drug Search for Leishmaniasis, das sich zum Ziel gesetzt hat, neue Medikamente gegen resistente Stämme der Krankheit zu finden.[30]
Weitere durch Ektoparasiten übertragene Krankheiten
Literatur
- Écologie des leishmanioses, Montpellier 18–24 août 1974, Centre National de la Recherche Scientifique (CRNS), Paris 1977, ISBN 978-2-222-02042-4.
- N. Suttorp, M. Mielke u. a.: Infektionskrankheiten. Thieme, Stuttgart 2004, ISBN 3-13-131691-8.
- H. Hahn, D. Falke u. a.: Medizinische Mikrobiologie und Infektiologie. 5. Auflage. Springer, Berlin / Heidelberg 2004, ISBN 3-540-26529-5.
Leitlinien
- S1-Leitlinie Diagnostik und Therapie der viszeralen Leishmaniasis (Kala-Azar) der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit (DTG). In: AWMF online (Stand 2012)
- Diagnostik und Therapie der kutanen und mukokutanen Leishmaniasis in Deutschland (PDF) S1-Leitlinie der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit (DTG) in Zusammenarbeit mit der Paul-Ehrlich-Gesellschaft für Chemotherapie (PEG) und der Deutschen Dermatologischen Gesellschaft, 2010
Weblinks
- Leishmaniose – Informationen des Robert Koch-Instituts
- Informationen der WHO zur Leishmaniose (engl.)
Einzelnachweise
- T. J. Naucke, C. Schmitt: Is leishmaniasis becoming endemic in Germany? In: International Journal of Medical Microbiology. 293.Suppl. 37 (2004), S. 179–181.
- researchgate.net (PDF; 2,7 MB)
- Werner Köhler: Infektionskrankheiten. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 667–671; hier: S. 670.
- Horst Aspöck: Durch Arthropoden übertragene Erreger von Infektionen des Menschen in Mitteleuropa – ein Update. (PDF) In: Mitt. Dtsch. Ges. allg. angew. Ent.. 16, 2008, S. 371–392.
- Sandmücken in Hessen angekommen – Erreger können schwere Schäden verursachen
- World Health Organization: Leishmaniases fact sheet 2. März 2020
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 175 f. (Kala-Azar).
- P. Desjeux: Leishmaniasis. In: Nature reviews. Microbiology. Sept. 2004, Nr. 2, S. 692, PMID 15378809
- S. M. Beverley: Protozomics: Trypanosomatid parasite genetics comes of age. In: Nature Reviews Genetics. Jan. 2003, Nr. 4, S. 11–19, PMID 12509749
- B. L. Herwaldt: Leishmaniasis. In: The Lancet. Oct. 1999, Nr. 354, S. 1191–1199, PMID 10513726
- F. Pratlong, J. Dereure u. a.: Sudan: the possible original focus of visceral leishmaniasis. In: Parasitology. Juni 2001, Nr. 122, S. 599–605. PMID 11444612
- Albert R. Zink u. a.: Letter: Leishmaniasis in Ancient Egypt and Upper Nubia. In: Emerging Infectious Diseases. Oct. 2006, Vol. 12, Nr. 10, vollständiger Text
- Georg Sticker: Hippokrates: Der Volkskrankheiten erstes und drittes Buch (um das Jahr 434–430 v. Chr.). Aus dem Griechischen übersetzt, eingeleitet und erläutert. Johann Ambrosius Barth, Leipzig 1923 (= Klassiker der Medizin. Band 29); unveränderter Nachdruck: Zentralantiquariat der Deutschen Demokratischen Republik, Leipzig 1968, S. 107 (Ein schleichendes Fieber mit Milzvergrößerung […].)
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. 1961, S. 176.
- https://www.who.int/en/news-room/fact-sheets/detail/leishmaniasis
- Afif Ben Salah, Nathalie Ben Messaoud, Evelyn Guedri, Amor Zaatour, Nissaf Ben Alaya, Jihene Bettaieb, Adel Gharbi, Nabil Belhadj Hamida, Aicha Boukthir, Sadok Chlif, Kidar Abdelhamid, Zaher El Ahmadi, Hechmi Louzir, Mourad Mokni, Gloria Morizot, Pierre Buffet, Philip L. Smith, Karen M. Kopydlowski, Mara Kreishman-Deitrick, Kirsten S. Smith, Carl J. Nielsen, Diane R. Ullman, Jeanne A. Norwood, George D. Thorne, William F. McCarthy, Ryan C. Adams, Robert M. Rice, Douglas Tang, Jonathan Berman, Janet Ransom, Alan J. Magill, Max Grogl: Topical Paromomycin with or without Gentamicin for Cutaneous Leishmaniasis. In: New England Journal of Medicine. 2013; Band 368, Ausgabe 6 vom 7. Februar 2013, S. 524–532 doi:10.1056/NEJMoa1202657.
- Ana Gallego-Fernandez et al.: Feline leishmaniosis: diagnosis, treatment and outcome in 16 cats. In: J. Feline Med. Surg. Band 13, 2020. PMID 32053024, doi:10.1177/1098612X20902865
- Ernst-Günther Grünbaum, Ernst Schimke (Hrsg.): Klinik der Hundekrankheiten. 3., neu bearbeitete Auflage. Enke, Stuttgart 2007, ISBN 978-3-8304-1021-8, S. 280–281 (online).
- Rüdiger Dörris: Medizinische Mikrobiologie. Georg Thieme Verlag, ISBN 3-13-125313-4, S. 527.
- Marianne Abele-Horn (2009), S. 292.
- DPMAregister (abgerufen am 8. Januar 2013)
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 292.
- Franz von Bruchhausen (Hrsg.), Siegfried Ebel, Eberhard Hackenthal und Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis: Folgeband 5: Stoffe L–Z, 5. Auflage, Springer-Verlag, Berlin Heidelberg, 1999, ISBN 978-3-642-63569-4; ISBN 978-3-642-58388-9 (eBook); doi:10.1007/978-3-642-58388-9
- Gelbe Liste Online: Impavido 50 mg Kapseln | Gelbe Liste. Abgerufen am 2. Februar 2021.
- Marianne Abele-Horn (2009), S. 292.
- Marianne Abele-Horn (2009), S. 292.
- P. Gómez-Ochoa, J. A. Castillo, M. Gascón, J. J. Zarate, F. Alvarez, C. G. Couto: Use of domperidone in the treatment of canine visceral leishmaniasis: a clinical trial. In: Veterinary journal (London, England: 1997). Band 179, Nummer 2, Februar 2009, ISSN 1090-0233, S. 259–263. doi:10.1016/j.tvjl.2007.09.014. PMID 18023375
- Adjuvantierter Impfstoff für Hunde gegen Leishmania infantum. European Medicines Agency, EMA/296055/2010, ema.europa.eu (PDF; 133 kB).
- Ralph Lainson obituary in: The Guardian, 18. Mai 2015, abgerufen 8. Mai 2015.
- worldcommunitygrid.org