Wasserstoffatom
Ein Wasserstoffatom ist ein Atom des chemischen Elements Wasserstoff (Symbol: H). Das Atom besteht aus einem einfach positiv geladenen Atomkern (mit einem Proton und bei natürlich vorkommenden Isotopen null bis zwei Neutronen) und einem negativ geladenen Elektron. Elektron und Atomkern sind aufgrund ihrer entgegengesetzten elektrischen Ladung aneinander gebunden (Coulombsches Gesetz).
Das Wasserstoffatom ist das am einfachsten aufgebaute aller Atome und bietet den Schlüssel zum Verständnis des Aufbaus und der Eigenschaften aller Atome. Es ist das einzige Atom, für das die quantenmechanische Schrödinger-Gleichung analytisch, d. h. in mathematisch geschlossener Form, gelöst werden kann. Die Spektrallinien des Wasserstoffatoms sind mit hoher Genauigkeit berechenbar und können mit den gemessenen Werten verglichen werden, wie z. B. das bekannteste Linienmultiplett, die Balmer-Serie.
Das Wasserstoffatom als Paradebeispiel der Entwicklung der Atomphysik
Die am Wasserstoffatom nach und nach abgeleiteten Prinzipien der Atomphysik bilden heute die Grundlage zur Beschreibung aller Atome.[1]
Vor 1913
William Prout vermutete 1815, dass die Atome aller Materie aus Wasserstoffatomen aufgebaut seien. Zur Begründung führte er an, dass Wasserstoff nach John Dalton das kleinste aller Atomgewichte habe (auch heute richtig) und die Atomgewichte anderer Elemente ein ganzzahliges Vielfaches davon seien – dies war allerdings schon nach damaligem Kenntnisstand falsch, zur Begründung siehe Isotope.[2] Nach heutiger Ansicht findet dieser Aufbauprozess tatsächlich bei der Nukleosynthese in Supernovae statt.
Johann Balmer fand 1885 zwischen den Wellenlängen der vier sichtbaren Spektrallinien des Wasserstoffatoms einen mit einfachen ganzen Zahlen darstellbaren mathematischen Zusammenhang, die Balmer-Formel. Er war nach der Entdeckung (durch Robert Wilhelm Bunsen und Gustav Robert Kirchhoff 1860), dass jedes Element spezifische Spektrallinien zeigt, davon ausgegangen, dass eine Erklärung hierfür am ehesten im Fall des Wasserstoffs zu finden sein müsste, weil dieser das leichteste Atomgewicht und das einfachste Linienspektrum zeigt. Balmer nutzte seine Formel, um die genaue Lage weiterer Linien im Ultravioletten vorherzusagen, und erfuhr dann zu seiner Überraschung, dass diese in Sternspektren bereits genau dort gefunden worden waren.[3]
Joseph John Thomson identifizierte 1897 das Elektron als universellen Bestandteil aller Materie[4] und formulierte 1903 ein Atommodell mit einer masselosen positiven Ladung von der Größe des Atoms und einer genügenden Anzahl von Elektronen, um die Atommasse zu erklären, für das H-Atom nicht weniger als etwa 2000.[5] Die Elektronen sollten in der positiven Ladung verteilt sein wie „die Rosinen im Kuchen“ und um ihre Ruhelage schwingen können, was die Emission und Absorption von Licht bestimmter Frequenzen im Rahmen der klassischen Physik erklärbar machte, ebenso wie die Streuung von Licht- und Röntgenstrahlung. Besonders beachtet wurde, dass dieses Modell auch die Aufspaltung der Lichtfrequenz im Magnetfeld wenigstens in den Fällen erklären konnte, in denen man eine dreifache Aufspaltung sah (normaler Zeeman-Effekt, 1896). Unerklärlich blieb, wie eine solche Anordnung so stabil sein konnte, wie es die Atome offensichtlich sind. Zudem erwies sich (ab 1906) die Streuung von Röntgenstrahlung viel schwächer als vorhergesagt, was für eine viel kleinere Anzahl Elektronen im Atom sprach: für Wasserstoff höchstens einige wenige.
Arthur Haas zeigte 1910 zum ersten Mal, dass unter Zuhilfenahme der 1900 entdeckten planckschen Konstante h eine Formel aufgestellt werden kann, die für den Radius und die Bindungsenergie des Wasserstoffatoms richtige Werte ergibt.[6] Das war die erste Anwendung der bis dahin fast ausschließlich für Lichtwellen und andere harmonische Schwingungen benutzten planckschen Formel auf ein Problem der Mechanik des Atoms – und wurde aus genau diesem Grund auch weitgehend abgelehnt. Haas betrachtete ein Elektron (Ladung -e) auf einer Kreisbahn auf der Oberfläche einer positiv geladenen Kugel mit der Ladung +e und setzte versuchsweise dessen potentielle Energie Epot und Umlauffrequenz f, beide nach der klassischen Physik ermittelt, in das Verhältnis . Das Ergebnis entspricht schon genau dem Grundzustand des bohrschen Modells.
1913–1925
Niels Bohr zeigte 1913 in seinem bohrschen Atommodell, dass mit der Annahme eines kleinen, positiven, schweren Atomkerns (nach Ernest Rutherfords Entdeckung 1911) und weiteren Annahmen (später verfeinert und bohrsche Postulate genannt) die Energien des H-Atoms auch in angeregten Zuständen zutreffend berechnet werden können. Obwohl diese Postulate radikale Brüche mit der klassischen Physik bedeuteten, setzte sich das Modell schnell durch, denn es konnte nicht nur die Balmer-Formel, sondern auch das Spektrum des ionisierten Helium-Atoms (ein Elektron umkreist einen Atomkern mit doppelter Ladung und vierfacher Masse) richtig erklären, einschließlich des kleinen Effekts der verschiedenen Kernmassen, sowie die Energien der harten Röntgenstrahlung der schwereren Elemente.
Arnold Sommerfeld erweiterte 1916 das Modell um elliptische Bahnen zum bohr-sommerfeldschen Atommodell. Er entdeckte dabei die drei räumlichen Quantenzahlen und die Richtungsquantelung des Drehimpulses, sodass er die (ungeradzahlige) Aufspaltung der Energieniveaus im Magnetfeld erklären konnte. Durch Berücksichtigung der speziellen Relativitätstheorie konnten weitere Feinheiten der Spektrallinien des H-Atoms gedeutet werden. Das Modell versagte aber genau wie das bohrsche Modell bei Atomen mit mehreren Elektronen.
Quantenmechanik
Der Durchbruch zur heutigen Modellvorstellung gelang 1925/26 mit der Entdeckung der Quantenmechanik durch Werner Heisenberg (Matrizenmechanik) und Erwin Schrödinger (Wellenmechanik). Bewegungsgleichungen in neuer Form machen darin die bohrschen Postulate überflüssig. Prüfstein der neuen Theorien war die exakte Berechnung des H-Atoms. Mit der Matrizenmechanik gelang dies erstmals Wolfgang Pauli. Die erste Berechnung nach der Wellenmechanik (s. u.), die zusätzlich zu den Energien die geometrische Form der Elektronenorbitale liefert, wurde von Schrödinger selbst präsentiert. Systeme mit mehr als einem Elektron können zwar auch hier nicht mehr mathematisch exakt behandelt werden, Näherungsmethoden machen aber möglich, das Verhalten von Atomen mit vielen Elektronen mit hoher Genauigkeit zu berechnen. Das quantenmechanische Modell führte zum Schalenmodell und damit zum Verständnis des Aufbaus des Periodensystems der Elemente und der Bildung von Molekülen in der chemischen Bindung.
Relativistische Quantenmechanik
Als Paul Dirac 1927 die relativistisch korrekte Formulierung der Quantenmechanik veröffentlichte, konnte er damit nicht nur weitere Feinheiten der Spektrallinien des Wasserstoffatoms erklären, sondern auch die vorher unverständlichen Eigenschaften des Elektrons wie Spin und anomales magnetisches Moment. Damit war auch die geradzahlige Aufspaltung der Energieniveaus im anomalen Zeeman-Effekt verstanden. Zudem ergab sich aus der Diracgleichung die neue Vorhersage von Antiteilchen.
Quantenelektrodynamik
Die im Rahmen der Quantenelektrodynamik theoretisch erwartete Vakuumpolarisation durch virtuelle Teilchen-Antiteilchenpaare wurde an H-Atomen 1947 erstmals anhand einer extrem kleinen Aufspaltung eines Energieniveaus (Lamb-Verschiebung) nachgewiesen. Dies verhalf der Quantenelektrodynamik, insbesondere dem darin erforderlichen Verfahren der Renormierung, zum Durchbruch. Dass die Quantenelektrodynamik auch für die klassische elektrostatische Anziehung eine Erklärung durch Austausch virtueller Photonen bietet, wurde 1952 durch Hans Bethe und E. Salpeter anhand einer erneuten genauen Berechnung der Energieniveaus des H-Atoms gezeigt (Bethe-Salpeter-Gleichung).
Dynamische Gruppe
Wolfgang Pauli hatte bei seiner ersten Behandlung[7] des Wasserstoffatoms in der heisenbergschen Matrizenmechanik einen Weg gefunden, die genauen Eigenschaften des Coulomb-Potentials einfach durch eine zusätzliche Konstante, den Laplace-Runge-Lenz-Vektor, zu berücksichtigen. Das entspricht mathematisch einer Rotationssymmetrie in 4 Dimensionen (Symmetriegruppe O(4)). Durch Erweiterung zur Dynamischen Symmetriegruppe O(4,2) konnte Hagen Kleinert 1968 nicht nur die Energieterme, sondern auch die Dipol-Matrixelemente für alle atomaren Übergänge in einer irreduziblen Gruppendarstellung vereinen.[8]
Pfadintegral
Im Jahre 1979 fand Hagen Kleinert eine Lösung für das Wasserstoffatom in Feynmans Pfadintegral-Zugang zur Quantenmechanik[9][10] und erweiterte damit den Anwendungsbereich dieser in der modernen Quantenmechanik wichtigen Methode.
Experimentelle Untersuchungen der optischen Linienspektren
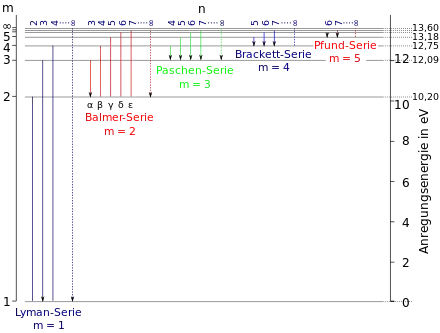
Seit 1862 werden die Spektrallinien im Absorptions- und Emissionsspektrum des Wasserstoffatoms untersucht. Sie werden verursacht durch den Übergang des gebundenen Elektrons von einem höheren in ein niedrigeres Niveau (Emission) oder umgekehrt (Absorption). Dabei werden die möglichen Linien klassifiziert nach dem Grundniveau und benannt nach ihren jeweiligen Entdeckern. Mathematisch werden die Übergänge seit 1888 durch die Rydberg-Formel beschrieben. Albert A. Michelson fand 1892, dass die Spektrallinien feine Aufspaltungen zeigen. Diese konnten teilweise erst 1916 durch das bohr-sommerfeldsche Atommodell erklärt werden, vollständig ab 1926 durch die Quantenmechanik.
| Name der Serie | Grundniveau | Wellenlängenbereich | Entdeckungsjahr |
|---|---|---|---|
| Lyman-Serie | 1 | ultraviolett | 1906 |
| Balmer-Serie | 2 | sichtbar bis ultraviolett | 1885 |
| Paschen-Serie | 3 | infrarot | 1908 |
| Brackett-Serie | 4 | infrarot | 1922 |
| Pfund-Serie | 5 | infrarot | 1924 |
Lösung der Schrödinger-Gleichung (Wasserstoffproblem)
Die einfachste Schrödinger-Gleichung für ein geladenes Teilchen im Coulombfeld einer Punktladung wird als Wasserstoffproblem bezeichnet. Diese dreidimensionale partielle Differentialgleichung kann aufgrund der Kugelsymmetrie der elektromagnetischen Wechselwirkung in drei unabhängige Gleichungen separiert werden. Jede der drei Einzelgleichungen kann mathematisch exakt gelöst werden.
Eine der Gleichungen ergibt die Form der Abstandsabhängigkeit der Elektronenwellenfunktion in den Energiezuständen und die Energiewerte des Elektrons im Wasserstoffatom. Es ist üblich, die verschiedenen diskreten Energiewerte über die Hauptquantenzahl als zu bezeichnen. Der tiefste Energiezustand[Anmerkung 1] heißt .
Die beiden anderen Gleichungen enthalten die Winkelabhängigkeit der Wellenfunktion mit der Bahndrehimpulsquantenzahl und der magnetischen Quantenzahl .
Das Wasserstoffatom ist eines der wenigen quantenmechanischen Systeme, die sich exakt berechnen lassen. Die Lösung der Schrödinger-Gleichung für das Wasserstoffatom ist auch deshalb ein Standardbeispiel der universitären Physik- und Chemieausbildung.
Mathematische Details

Für das System von einem Elektron (Masse , Ort , Ladung ) und dem Atomkern (Masse , Ort , Ladung , wobei ganzzahlig ist), wobei die Coulombwechselwirkung die potentielle Energie bestimmt, gilt zunächst die zeitunabhängige Schrödingergleichung:
- .
Die Laplace-Operatoren sind jeweils die zweiten räumlichen (partiellen) Ableitungen nach den Koordinaten bzw. . Unter Übergang in das Schwerpunktsystem und Betrachtung der Relativbewegung () von Elektron und Atomkern ergibt sich nach Separation folgende Schrödingergleichung:
- .
Es ist die reduzierte Masse des Systems. Diese lässt sich aufgrund durch nähern. Diese Gleichung ist ansonsten identisch zu der Schrödingergleichung eines Teilchens in einem kugelsymmetrischen Potential. Die Separation dieser Gleichung in Kugelkoordinaten (Abstand vom Mittelpunkt), (Breitenwinkel) und (Längenwinkel) führt zu drei Gleichungen, die von jeweils nur einer der Koordinaten abhängen. Eine vollständige Lösung ergibt sich als das Produkt der Lösungen dieser drei Gleichungen.
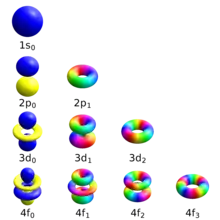
Jede Lösung der Schrödingergleichung für das Wasserstoffatom wird durch die drei ganzen Zahlen gekennzeichnet. Sie werden Quantenzahlen genannt, genauer: räumliche Quantenzahlen im Unterschied zur später hinzukommenden Spin-Quantenzahl . Dabei ist die Haupt- oder Energiequantenzahl eine beliebige positive Zahl, die Drehimpulsquantenzahl nimmt für gegebenes die Werte von bis an, und die magnetische Quantenzahl durchläuft für gegebenes die ganzen Zahlen von bis . Die Lösungsfunktion ist dann
mit
- (darin ist der Bohrsche Radius des H-Atoms);
- sind die zugeordneten Laguerre-Polynome;
- sind die Kugelflächenfunktionen.
Die Radialfunktion ist für alle Werte der magnetischen Quantenzahl dieselbe. Die winkelabhängigen Funktionen sind von der Hauptquantenzahl unabhängig.
Für die niedrigsten Orbitale ergibt sich damit:
Die Energieeigenwerte sind
mit
mit der Lichtgeschwindigkeit , der Feinstrukturkonstante und der Rydberg-Energie .
Die Eigenwerte für Drehimpulsquantenzahl und magnetische Quantenzahl sind durch
und
gegeben.
Die Drehimpulsquantenzahl misst hierbei den Bahndrehimpuls des Elektrons, und die magnetische Quantenzahl seine Projektion auf eine beliebig festgelegte Richtung, die im Allgemeinen als z bezeichnet wird (z steht dabei für die z-Achse).
In dieser einfachsten Behandlung des Wasserstoffatoms sind die Energiewerte nur von der Hauptquantenzahl abhängig. Alle Zustände mit gleichem (und damit auch alle ihre möglichen Linearkombinationen) besitzen hier die gleiche Energie. Man sagt daher, sie sind entartet bezüglich der Quantenzahlen und
Die Entartung bezüglich gilt allgemein für jedes kugelsymmetrische Potential, weil dann die Energie eines Eigenzustands nicht von der Orientierung des Drehimpulses bezüglich der -Achse abhängen kann. Die Entartung bezüglich hingegen ist eine Besonderheit des ()-Potentials. Sie erklärt die besonders große elektrische Polarisierbarkeit (linearer Stark-Effekt) des angeregten Wasserstoffatoms. In Atomen mit mehreren Elektronen ist die -Entartung schon aufgrund der Veränderung der Potentialform durch die abstandsabhängige Abschirmung der Kernladung durch die anderen Elektronen aufgebrochen, was für den Aufbau des Periodensystems der Elemente von großer Bedeutung ist. Die -Entartung gilt jedoch (in guter Näherung) immer, wenn ein Elektron sich in großem Abstand von allen anderen befindet, also in einem Rydberg-Zustand. Weitere Effekte (Spin, Relativitätstheorie) ergeben eine geringfügige Aufhebung der -Entartung auch schon im H-Atom.
- Der tiefste Energiezustand (Grundzustand) wird sonst in der Quantenmechanik meistens mit bezeichnet.
Weitere Entwicklung
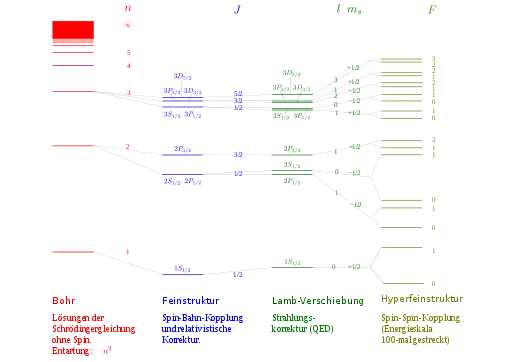
Die Schrödinger-Gleichung gibt eine in erster Näherung ausgezeichnete Beschreibung des Wasserstoffatoms. Sie vernachlässigt allerdings einige Sachverhalte, die experimentell nachweisbar sind und im Rahmen einer relativistischen Behandlung streng formal hergeleitet werden können. Einige dieser Korrekturen können durch Modifikation der nichtrelativistischen Gleichung erklärt werden:
Relativistische Effekte
Die Schrödinger-Gleichung ist eine nichtrelativistische Gleichung und verwendet den klassischen Ausdruck für die kinetische Energie. Zur korrekten Beschreibung muss man deshalb eine relativistische Gleichung für die zeitliche Entwicklung verwenden. Beim Wasserstoffatom ist der Energieunterschied aber nicht sehr groß, daher kann man die Effekte störungstheoretisch im Rahmen der Schrödinger-Gleichung behandeln, um genauere Werte für die Energieeigenwerte zu erhalten.
Spin
Der Spin des Elektrons ist ebenfalls ein nicht klassischer Effekt, der sich in der relativistischen Dirac-Gleichung verstehen lässt, welche für Fermionen mit Spinwert zugeschnitten ist.
Aufgrund seines Spins besitzt das Elektron ein magnetisches Moment, das mit anderen magnetischen Momenten und Magnetfeldern wechselwirken kann.
Die Wechselwirkung mit dem magnetischen Moment, welches das Elektron durch seine Bewegung um den Atomkern erzeugt, wird dabei als Spin-Bahn-Kopplung bezeichnet. Dieser und andere Effekte bewirken eine teilweise Aufspaltung der entarteten Energieniveaus, die Feinstruktur des Wasserstoffatoms. Berücksichtigt man noch die Wechselwirkung von Spin und Bahndrehimpuls mit dem Kernspin, ergibt sich eine noch feinere Aufspaltung, die sogenannte Hyperfeinstruktur.
In Anwesenheit von Magnetfeldern beobachtet man aufgrund des Spins des Elektrons den anomalen Zeeman-Effekt.
Quantenfeldtheoretische Effekte
Auch die Beschreibung eines Elektrons mit Hilfe der relativistischen Diracgleichung bei sogenannter minimaler Kopplung an ein elektromagnetisches Feld lässt viele physikalische und mathematische Probleme ungelöst.
Erst relativistische Quantenfeldtheorien konnten alle heute bekannten und messbaren Eigenschaften des Wasserstoffatoms (und auch der aller anderen Atome) erklären und prinzipiell aus Naturkonstanten und Elementarteilcheneigenschaften berechenbar machen. Die QFT sind Vielteilchentheorien, in denen mittels zweiter Quantisierung alle Kräfte durch Wechselwirkungsteilchen erklärt werden, wodurch neue Effekte wie die Vakuumfluktuationen beschrieben werden. Diese bedingen zum Beispiel die Lamb-Verschiebung (engl. lamb shift) der Energieniveaus, was erstmals im Lamb-Retherford-Experiment nachgewiesen wurde, sowie Korrekturen am gyromagnetischen Faktor. Auch die spontane Emission von Photonen aus angeregten Zuständen des Atoms konnte – samt der Übergangswahrscheinlichkeiten – erst mit Hilfe der Quantenelektrodynamik richtig erklärt werden.
Die Quantenelektrodynamik, eine Quantenfeldtheorie in der die Wirkung des elektromagnetischen Feldes letztendlich auf Photonen, die „Licht-Teilchen“, zurückgeführt wird, liefert momentan das genaueste Modell der Elektronenhülle des Wasserstoffatoms.
Literatur
- Abraham Pais: Inward Bound: Of Matter and Forces in the Physical World. Clarendon Press, Oxford 1986.
- Jörn Bleck-Neuhaus: Elementare Teilchen. Moderne Physik von den Atomen bis zum Standard-Modell. Springer, Heidelberg 2010, ISBN 978-3-540-85299-5.
- David J. Griffiths: Introduction to Quantum Mechanics. 2. Auflage. Prentice Hall International, Upper Saddle River, NJ 2004, ISBN 0-13-111892-7 (Abschnitt 4.2 setzt sich genauer mit dem Wasserstoffatom auseinander).
- B. H. Bransden, Charles J. Joachain: Physics of Atoms and Molecules. Longman, London 1982, ISBN 0-582-44401-2.
- Hagen Kleinert: Path Integrals in Quantum Mechanics, Statistics, Polymer Physics, and Financial Markets: 5th Edition. 5. Auflage. World Scientific Publishing Co Pte Ltd, 2009, ISBN 981-4273-55-4 (auch online lesbar).
Weblinks
Einzelnachweise
- Ausführlicher und mit weiteren vorgeschlagenen Modellen in: Helge Kragh Before Bohr: Theories of atomic structure 1850–1913. RePoSS: Research Publications on Science Studies 10. Århus: Department of Science Studies, University of Aarhus.
- siehe F. Dannemann: Die Naturwissenschaften in ihrer Entwicklung und in ihrem Zusammenhange, Bd. 3, Verlag W. Engelmann 1922, S. 198.
- J.J. Balmer: Notiz über die Spektrallinien des Wasserstoffs, Annalen der Physik Bd. 25 (1885) S. 80–87 (online bei wiley: Bd. 261 Heft 5).
- J.J. Thomson: Phil. Mag. Bd. 44 (1897) S. 547.
- J.J. Thomson: Phil. Mag. Bd. 6 (1903) S. 673.
- A.E. Haas: Phys. Zeitschr. Bd. 11 (1910) S. 537.
- W Pauli: Über das Wasserstoffspektrum vom Standpunkt der neuen Quantenmechanik. In: Zeitschrift für Physik. 36, 1926, S. 336–363. doi:10.1007/BF01450175.
- Hagen Kleinert: Group Dynamics of the Hydrogen Atom. In: Lectures in Theoretical Physics, edited by W.E. Brittin and A.O. Barut, Gordon and Breach, N.Y. 1968. 1968, S. 427–482.
- Duru I.H., Hagen Kleinert: Solution of the path integral for the H-atom. In: Physics Letters B. 84, Nr. 2, 1979, S. 185–188. doi:10.1016/0370-2693(79)90280-6.
- Duru I.H., Hagen Kleinert: Quantum Mechanics of H-Atom from Path Integrals. In: Fortschr. Phys. 30, Nr. 2, 1982, S. 401–435. doi:10.1002/prop.19820300802.