Spektroskopie
Spektroskopie bezeichnet eine Gruppe physikalischer Methoden, die eine Strahlung nach einer bestimmten Eigenschaft wie Wellenlänge, Energie, Masse etc. zerlegen. Die dabei auftretende Intensitätsverteilung wird Spektrum genannt.

Spektrometrie ist die quantitative Ausmessung von Spektren mittels eines Spektrometers. Die Aufzeichnungsmethode heißt Spektrografie[1] und die Aufzeichnung (grafische Darstellung) selbst Spektrogramm, wird im Fachjargon aber oft einfach als „das Spektrum“ bezeichnet. Zur visuellen Betrachtung optischer Spektren dienen Spektroskope, wie erstmals bei Isaac Newton, als er im 17. Jahrhundert die Zusammensetzung des weißen Lichts aus Spektralfarben entdeckte.
Die untersuchten Strahlungen umfassen den gesamten Bereich der elektromagnetischen Wellen und der mechanischen Wellen wie Schall und Wasserwellen, sowie Teilchenstrahlen z. B. aus Elektronen, Ionen, Atomen oder Molekülen. Die Spektroskopie wird eingesetzt, um die Eigenschaften der Strahlung selbst zu studieren, die Eigenschaften der Strahlenquelle herauszufinden (Emissionsspektroskopie) oder die Eigenschaften eines zwischen der Quelle und dem Spektrometer befindlichen Transportmediums zu untersuchen (Absorptionsspektroskopie). Insbesondere kann Spektrometrie genutzt werden, um Art und Konzentration von emittierenden oder absorbierenden Substanzen zu bestimmen.
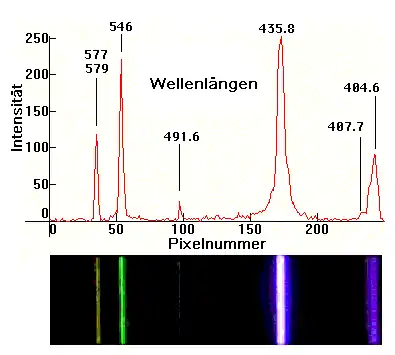
Zeigt ein Spektrum scharfe und voneinander getrennte Intensitätsmaxima, wird es allgemein als Linienspektrum bezeichnet, andernfalls als kontinuierliches Spektrum. Oft sind Spektren aus diesen beiden Grundtypen gemischt. Der Name Linienspektrum erklärt sich daraus, dass die ersten optischen Spektralapparate das Licht aus einem beleuchteten schmalen Spalt empfingen, der abhängig von der Wellenlänge an einen bestimmten Ort auf dem Schirm abgebildet wurde, so dass sich für jedes Intensitätsmaximum eine helle Linie bildete (siehe Abbildung).
Beispielsweise ist das Energie- oder Wellenlängenspektrum der Wärmestrahlung vom kontinuierlichen Typ mit einem breiten Maximum, an dessen Lage man auch die Temperatur des strahlenden Körpers ablesen kann. Hingegen zeigt das von Atomen ausgesandte oder absorbierte Licht ein Linienspektrum, an dem man die chemischen Elemente, zu denen die Atome gehören, eindeutig identifizieren kann (Spektralanalyse nach Kirchhoff und Bunsen, 1859). Auch das Massenspektrum eines Stoffes bei Untersuchung mit einem Massenspektrometer ist ein Linienspektrum, das die Massen der im Stoff vorhandenen Moleküle oder gegebenenfalls ihrer Bruchstücke anzeigt. Die beiden Arten von Linienspektren zeigen hohe Empfindlichkeit und werden daher bei chemischen Analysen routinemäßig zum Nachweis von Beimengungen fremder Stoffe in geringster Konzentration eingesetzt.
Die Spektrografie wird in verschiedensten Formen beispielsweise in der Medizin, in der kriminalistischen Chemie, der forensischen Toxikologie und der forensischen Biologie eingesetzt.[2] Spektroskopische Beobachtungen der Linienspektren der Atome und Moleküle gaben entscheidende Impulse für die Entwicklung der Atomphysik und Quantenmechanik. Die hohe Präzision, mit der viele ihrer Spektrallinien gemessen werden können, erlaubt u. a. die genaue Überprüfung von Naturgesetzen, die Bestimmung von Naturkonstanten und die Definition der Basiseinheiten Meter und Sekunde.
Spektroskopie elektromagnetischer Strahlung
Physikalische Grundlagen
Ein Spektrum im Sinne dieses Artikels ist die Verteilung einer spektralen Leistungsdichte über einer Energieskala (Frequenz, Wellenzahl) oder einer reziproken Energieskala. Der Zusammenhang zwischen der Frequenz einer elektromagnetischen Welle und der Energie der Lichtquanten ist dabei gegeben durch
mit der Planck-Konstanten .
Grundlage zum Verständnis von Spektren ist der Übergang eines Systems zwischen verschiedenen Energieniveaus unter Emission oder Absorption von Photonen oder anderen Teilchen. Mit diesem kann man Absorption und Emission von Photonen durch Übergänge zwischen verschiedenen Energieniveaus eines Atoms beschreiben. Die absorbierte bzw. emittierte Energie ist dabei durch das anfängliche Energieniveau und dem End-Energieniveau festgelegt. In der Quantenmechanik hat jeder Zustand ein Energieniveau.
Dabei gilt:
Ist , die Differenz also positiv, so handelt es sich in diesem Beispiel um Emission, bei negativen Vorzeichen, also dann um Absorption.
Strukturen im Spektrum geben Hinweise darauf, welche Energiebeträge eine Substanz aufnehmen (absorbieren) oder abgeben (emittieren) kann. Diese Beträge entsprechen Energiedifferenzen quantenmechanischer Zustände der Probe. Das Spektrum eines Stoffes hängt insbesondere ab von dessen Konzentrationen, von Auswahlregeln und Besetzungszahlen.
Klassische Spektroskopie
Die Untersuchung der Lichtemission bzw. -absorption von Molekülen und Atomen mit Hilfe von Gitter- und Prismenspektrometern sind die ältesten spektroskopischen Verfahren. Sie werden daher auch als klassische Spektroskopie bezeichnet. Viele der grundlegenden Untersuchungen über den Aufbau des Atoms wurden erst durch die Entwicklung und Anwendung hochauflösender Gitter- und Prismenspektrometer möglich.
Spektroskopiearten
Die Einteilung der zahlreichen spektroskopischen Methoden und Verfahren ist vielfältig und in der Literatur nicht immer einheitlich. Allgemein unterscheidet man zunächst zwischen Methoden der Atom- und der Molekülspektroskopie. Die Atomspektroskopie umfasst spektroskopische Verfahren, die auf Emissions-, Absorptions- oder Fluoreszenzvorgängen bei Atomen zurückgehen und zur Bestimmung von chemischen Elementen eingesetzt werden. Die beobachteten Spektren sind im Allgemeinen Linienspektren. Die molekülspektroskopischen Verfahren basieren hingegen auf der Anregung und Auswertung von Rotations-, Schwingungs- und Elektronenzuständen in Molekülen. Durch die Überlagerung von Einzelzuständen werden dabei keine Linienspektren, sondern sogenannte Bandenspektren beobachtet.
Neben dieser grundlegenden Einteilung, nach der Art der untersuchten Zuständen, gibt es zahlreiche andere Unterteilungen, beispielsweise nach der Anregungsenergie der elektrischen Strahlung (z. B. Mikrowellenspektroskopie, Röntgenspektroskopie), des Aggregatzustandes (z. B. Festkörperspektroskopie) oder der Art der Anregung (z. B. Elektronenspektroskopie, Laserspektroskopie).
| EM-Strahlung | Wellenlänge | Frequenzbereich | Wellenzahl | Energiebereich | untersuchte Eigenschaft | Spektroskopische Methode |
|---|---|---|---|---|---|---|
| Radiowellen | 100 m…1 m | 3·106…300·106 Hz | 10−4…0,01 cm−1 | 10−6…10−4 kJ/mol | Änderung des Kernspinzustandes | Kernresonanzspektroskopie (NMR, auch Hochfrequenzspektroskopie) |
| Mikrowellen | 1 m…1 cm | 300·106…30·109 Hz | 0,01…1 cm−1 | 10−4…0,01 kJ/mol | Änderung des Elektronenspinzustandes oder Hyperfeinzustandes | Elektronenspinresonanz (ESR/EPR), Ramsey-Spektroskopie (Atomuhren) |
| Mikrowellen | 10 cm…1 mm | 30·108…3·1011 Hz | 0.1…10 cm−1 | 0,001…0,1 kJ/mol | Änderung des Rotationszustandes | Mikrowellenspektroskopie |
| Terahertzstrahlung | 1 mm…100 µm | 0,3·1012…30·1012 Hz | 10…100 cm−1 | 0,1…1 kJ/mol | Änderung des Schwingungszustandes | Terahertz-Spektroskopie |
| Infrarotstrahlung | 1 mm…780 nm | 3·1011…3,8·1014 Hz | 10…1,28·104 cm−1 | 0,12…153 kJ/mol | Änderung des Schwingungszustandes | Schwingungsspektroskopie; (Infrarotspektroskopie (IR), Reflexionsspektroskopie und Ramanspektroskopie, Ultrakurzzeit-Spektroskopie) |
| sichtbares Licht; UV-Strahlung | 780 nm…10 nm | 3·1014…3·1016 Hz | 104…106 cm−1 | 100…104 kJ/mol | Änderung des Zustandes der äußeren Elektronen | UV/VIS-Spektroskopie (UV/Vis), Reflexionsspektroskopie, Fotoleitungsspektroskopie, Fluoreszenzspektroskopie; Ultrakurzzeit-Spektroskopie; Atomspektroskopie; Vergleich mit Frequenzkamm |
| Röntgenstrahlung | 10 nm…100 pm | 3·1016…3·1018 Hz | 106…108 cm−1 | 104…106 kJ/mol | Änderung des Zustandes der Rumpfelektronen | Röntgenspektroskopie (XRS); Elektronenspektroskopie; Auger-Elektronen-Spektroskopie (AES); |
| Gammastrahlung | 100 pm…1 pm | 3·1018…3·1020 Hz | 108…1010 cm−1 | 106…108 kJ/mol | Änderung des Kernzustandes (Anordnung der Nukleonen) | Gammaspektroskopie; Mößbauer-Spektroskopie |
Liste mit Spektroskopiearten und -methoden in der Analytik
- Atomspektroskopie – Messungen der Eigenschaften einzelner Atome, vor allem ihrer Elektronen-Energieniveaus
- Atomabsorptionsspektroskopie (AAS/OAS)
- Atomemissionsspektrometrie (AES/OES)
- Induktiv gekoppeltes Plasma (ICP-OES)
- Mikrowellen-Plasmafackel-AES (MPT-AES)
- Atomfluoreszenzspektroskopie (AFS)
- Gammaspektroskopie
- Gestörte Gamma-Gamma-Winkelkorrelation (PAC-Spektroskopie)
- Mößbauer-Spektroskopie (beruhend auf dem Mößbauer-Effekt)
- Elektronenspektroskopie
- Röntgenspektroskopie (XRS)
- Röntgenfluoreszenzanalyse (RFA)
- Röntgenbeugung (XRD)
- Röntgenabsorptionsspektroskopie (XAS)
- Glimmentladungsspektroskopie (GDOES)
- Molekülspektroskopie – Messungen der Eigenschaften einzelner Moleküle, vor allem der Valenzelektronen-Energieniveaus und der Molekülschwingungen und -rotationen
- Frequenzmodulationsspektroskopie
- Fluoreszenzspektroskopie
- Schwingungsspektroskopie
- Infrarotspektroskopie (IR)
- Ultraviolettspektroskopie (UV)
- Ramanspektroskopie
- Terahertz-Spektroskopie
- Kernresonanzspektroskopie (NMR, auch Hochfrequenzspektroskopie)
- CIDNP-Spektroskopie (auch NMR-CIDNP-Spektroskopie)
- Elektronenspinresonanz (ESR/EPR)
- Elektron-Kern-Doppelresonanz (ENDOR)
- Mikrowellenspektroskopie
- UV/VIS-Spektroskopie (UV/Vis)
- Festkörperspektroskopie – Messungen der Eigenschaften ganzer Festkörper (wie Kristalle), vor allem deren Bandstrukturdetails
- Absorptions- oder Transmissionsspektroskopie
- Reflexionsspektroskopie
- Fotoleitungsspektroskopie, siehe Photoelektrischer Effekt#Innerer photoelektrischer Effekt
- Impedanzspektroskopie (Dielektrische Spektroskopie)
- Laserspektroskopie
- Cavity-ring-down-Spektroskopie (CRDS, auch CRLAS)
- Laserinduzierte Fluoreszenz (LIF)
- Ultrakurzzeit-Spektroskopie – Messungen der Details von schnellen Vorgängen, vor allem chemischer Reaktionen
Spektroskopie in der Astronomie

Die Absorptionslinien im Sonnenspektrum wurden nach Josef Fraunhofer benannt, der sie 1813 entdeckte. Doch erst 1859 konnten Gustav Kirchhoff und Robert Bunsen die Natur dieser Linien als Fingerabdrücke von Elementen in der Sonnenatmosphäre erklären. In der folgenden Weiterentwicklung der Spektralanalyse gelang u. a. William Huggins (USA) und Angelo Secchi (Vatikansternwarte) die systematische Untersuchung von Sternspektren und die temperaturabhängige Klassifizierung der Sterne.
Die Spektralanalyse des Lichts der Sonne und anderer Sterne zeigte, dass die Himmelskörper aus denselben Elementen bestehen wie die Erde. Allerdings wurde Helium zuerst durch Spektroskopie des Sonnenlichtes identifiziert. Eine der solaren Spektrallinien konnte jahrzehntelang keiner bekannten Substanz zugeordnet werden, so dass bis zum Nachweis des irdischen Vorkommens angenommen wurde, auf der Sonne (griech. Helios) existiere ein unbekanntes Element.
Weitere klassische Erfolge der astronomischen Spektralanalyse sind
- der Nachweis des Doppler-Effektes an Sternen (siehe auch Radialgeschwindigkeit)
- und (um 1920) an Galaxien (siehe Rotverschiebung),
- die exakte fotografische Analyse des Sterns Tau Scorpii durch Albrecht Unsöld 1939
- von Magnetfeldern auf Sonne und hellen Sternen (Zeeman-Effekt)
- und vor allem die Feststellung von Stern-Temperaturen und der Spektralklassen (siehe auch Hertzsprung-Russell-Diagramm und Sternentwicklung).
Die zugehörigen Messinstrumente („Spektralapparate“) der Astrospektroskopie sind:
- das Spektroskop und das Spektrometer (beides visuell)
- der Spektrograf (fotografisch bzw. mit Sensoren)
- der Monochromator und das Interferenz-Spektrometer
- der Frequenzkamm[3]
Literatur
Allgemeine Lehrbücher
- Ludwig Bergmann, Clemens Schaefer: Lehrbuch der Experimentalphysik: Band 1 bis 8. De Gruyter.
- Peter M. Skrabal: Spektroskopie, Eine methodenübergreifende Darstellung vom UV- bis zum NMR-Bereich. vdf Hochschulverlag AG, Zürich 2009, ISBN 978-3-8252-8355-1.
- Physikalische Chemie#Literatur
Spezielle Werke
deutsch
- Wolfgang Demtröder: Molekülphysik: Theoretische Grundlagen und experimentelle Methoden. 1. Auflage. Oldenbourg, 2003, ISBN 3-486-24974-6.
- Wolfgang Demtröder: Laserspektroskopie: Grundlagen und Techniken. 5. Auflage. Springer, Berlin 2007, ISBN 978-3-540-33792-8.
- Hermann Haken, Hans Christoph Wolf: Atom- und Quantenphysik. 8. Auflage. Springer, Berlin 2003, ISBN 3-540-02621-5.
- Hermann Haken, Hans Christoph Wolf: Molekülphysik und Quantenchemie. 5. Auflage. Springer, Berlin 2006, ISBN 3-540-30314-6.
englisch
- Thomas Eversberg, Klaus Vollmann: Spectroscopic Instrumentation – Fundamentals and Guidelines for Astronomers. Springer, Heidelberg 2014, ISBN 3-662-44534-4
- Peter W. Atkins, Ronald Friedman: Molecular Quantum Mechanics. 4. Auflage. Oxford University Press, Oxford 2004, ISBN 0-19-927498-3.
- Peter F. Bernath: Spectra of Atoms and Molecules. 2. Auflage. Oxford University Press, Oxford 2005, ISBN 0-19-517759-2.
- Wolfgang Demtröder: Atoms, Molecules and Photons. Springer, Berlin 2005, ISBN 3-540-20631-0.
- Jack D. Graybeal: Molecular Spectroscopy. McGraw-Hill Education, New York NY u. a. 1988, ISBN 0-07-024391-3.
- J. Michael Hollas: Modern Spectroscopy. 4. Auflage. John Wiley & Sons, Chichester 2003, ISBN 0-470-84416-7.
- E. Bright Wilson Jr., J. C. Decius, Paul C. Cross: Molecular Vibrations – The Theory of Infrared and Raman Vibrational Spectra. Dover Publications, New York NY 1980, ISBN 0-486-63941-X.
- Gordon G. Hammes: Spectroscopy for the biological sciences. Wiley-Interscience, Hoboken NJ 2005, ISBN 0-471-71344-9.
Weblinks
Einzelnachweise
- Duden: Spektrografie.
- Jürgen Thorwald: Die Stunde der Detektive. Werden und Welten der Kriminalistik. Droemer Knaur, Zürich und München 1966, S. 356–370.
- Frequenzkamm in astronomischen Beobachtungen.