Dreifachbindung
Eine Dreifachbindung ist eine Form der chemischen Bindung zwischen zwei Atomen, die über Elektronenpaare vermittelt wird (→ Elektronenpaarbindung). Zwischen den Atomen gewährleisten drei Paare von Bindungselektronen den Zusammenhalt des darauf aufbauenden Moleküls.
Reaktivität von Dreifachbindungen
 |
 |
 | |
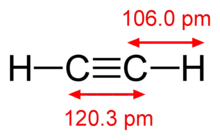
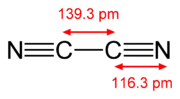
| Ethin | Dicyan | Kohlenstoffmonoxid | Stickstoff, N2 |
Eine Dreifachbindung hat eine sehr hohe Elektronendichte und sollte daher leicht elektrophile Additionsreaktionen eingehen. Im Fall von Kohlenstoff-Kohlenstoff-Dreifachbindungen trifft dies auch zu. Eine wesentliche Rolle spielt hierbei, dass C-C-Dreifachbindungen (C≡C) energiereicher sind als C-C-Doppel- oder Einfachbindungen (Bei der Bildung einer Dreifachbindung werden durchschnittlich 811 kJ·mol−1 frei, für jede Doppelbindung 615 kJ·mol−1 und für jede Einfachbindung 345 kJ·mol−1).[1] Dadurch wird ersichtlich, dass die Energieabgabe bei der Entstehung von drei einzelnen Bindungen anstelle einer einzigen Dreifachbindung höher ist. Die Differenzen werden in den meisten Fällen leicht durch die neu entstehenden Bindungen aufgebracht, und es resultiert üblicherweise ein beträchtlicher Energiegewinn bei Additionen an C-C-Dreifachbindungen.
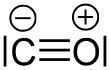
Beim Stickstoff sind die Verhältnisse genau umgekehrt. Die Dreifachbindung im Stickstoffmolekül N2 ist mit einer Bindungsenergie von 945 kJ·mol−1 relativ sehr viel energieärmer (= stabiler) als eine N-N-Doppelbindung (bei deren Bildung 466 kJ·mol−1) oder gar eine Einfachbindung (bei deren Bildung nur 159 kJ·mol−1 frei wird).[1] Dadurch wird ersichtlich, dass die Energieabgabe bei der Entstehung von drei einzelnen Bindungen anstelle einer einzigen Dreifachbindung niedriger ist. Diese Energieunterschiede können normalerweise nicht über die Bildung zusätzlicher Bindungen mit den Reaktionspartnern aufgebracht werden, und daher ist molekularer Stickstoff ein bekanntes Beispiel für das Auftreten einer starken Dreifachbindung mit hoher Stabilität und trägem Reaktionsverhalten.
Die höchste Bindungsenergie (1077 kJ·mol−1)[1] einer Dreifachbindung hat das Molekül Kohlenstoffmonoxid (Kohlenmonoxid, CO), da hier zusätzlich zur Dreifachbindung eine schwache ionische Bindung dazukommt.
Orbitalmodell der Dreifachbindung
Aus quantenchemischer Sicht kommen Bindungen durch Überlappung von Atomorbitalen zu einem Molekülorbital zustande. Die geläufigste Beschreibung der Dreifachbindung in Alkinen ist über eine Sigma-Bindung aus sp-Hybridorbitalen, die zwischen der Kernverbindungsachse liegt und zwei Pi-Bindungen, die untereinander einen Winkel von 90 Grad bilden und beide außerhalb der Kernverbindungsachse liegen. Eine alternative, vollkommen äquivalente Beschreibung benutzt drei gleichwertige „Bananenbindungen“, die durch Überlappung von sp3-Hybridorbitalen gebildet werden.
Bindungslänge nach Pauling
Kovalente Bindungslängen können nach Pauling als Summe zweier Atomradien abgeschätzt werden. Auf der Grundlage von experimentellen und quantenchemischen Daten wurden additive Kovalenzradien für Atome in Dreifachbindungen für die Elemente Beryllium bis Copernicium veröffentlicht.[2] Der verwendete Datensatz ist selbstkonsistent und enthält nur einen Radius für alle Oxidationszustände und Koordinationszahlen der berücksichtigten Elemente. Durch einfaches Addieren der Atomradien kann eine Vorhersage über die Dreifachbindungslänge gemacht werden.[3]
Moleküle mit Dreifachbindungen
Alkine
Moleküle, die C-C-Dreifachbindungen enthalten, gehören der Stoffgruppe der Alkine an. Die Chemie der Alkine ist durch Additionen von Elektrophilen an diese Bindung gekennzeichnet. Ein an einer Dreifachbindung beteiligtes Kohlenstoffatom ist sp-hybridisiert, daher sind Alkinanionen entsprechend stabil und als Nukleophile einsetzbar. Die Bindungslänge einer C-C-Dreifachbindung in Alkinen beträgt 120 pm.
Dreifachbindung mit Bor
2012 gelang es einer Arbeitsgruppe der Universität Würzburg erstmals eine Verbindung herzustellen, die eine bis etwa 200 °C stabile Dreifachbindung zwischen zwei Bor-Atomen enthält.[4]
Dreifachbindung mit Schwefel
1984 gelang einer Arbeitsgruppe an der Freien Universität Berlin zum ersten Mal eine Kohlenstoff-Schwefel-Dreifachbindung in Form des Trifluorethylidinschwefeltrifluorids zu synthetisieren. Es ist ein farbloses Gas, das schnell oligomerisiert.[5]
Siehe auch
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Pekka Pyykkö, Sebastian Riedel, Michael Patzschke: Triple-Bond Covalent Radii. In: Chemistry – A European Journal. Band 11, Nr. 12, 2005, S. 3511–3520, doi:10.1002/chem.200401299.
- Radii of Covalent Triple-Bonds bei psychem.de, nach Pekka Pyykkö, Sebastian Riedel, Michael Patzschke: Triple-Bond Covalent Radii. In: Chemistry – A European Journal. Band 11, Nr. 12, 2005, S. 3511–3520, doi:10.1002/chem.200401299.
- Lars Fischer: Club der Dreifachbindungen bekommt neues Mitglied. Meldung bei Spektrum.de vom 15. Juni 2012.
- Brigitte Pötter, Konrad Seppelt: Trifluorethylidinschwefeltrifluorid, F3C–C≡SF3. In: Angewandte Chemie. Band 96, Nr. 2, 1984, S. 138–138, doi:10.1002/ange.19840960207.