Silberchlorid
Silberchlorid [auch: Silber(I)-chlorid] kann zwar als das Silbersalz der Salzsäure (HCl) aufgefasst werden; als Edelmetall löst sich Silber jedoch nicht in Salzsäure, Silberchlorid bildet sich stattdessen aus wasserlöslichen Silberverbindungen wie Silbernitrat und Chlorid-Ionen.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Ag+ _ Cl− | ||||||||||||||||
| Kristallsystem |
kubisch | |||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | |||||||||||||||
| Gitterparameter |
a = 554,91 pm[1] | |||||||||||||||
| Koordinationszahlen |
Ag[6], Cl[6] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Silberchlorid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | AgCl | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle, Pulver erscheint weiß[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 143,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,56 g·cm−3 [4] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1550 °C[4] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (1,88 mg·l−1 bei 25 °C)[4] | |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Brechungsindex |
2,0668[6] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,01 mg·m−3 [4] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−127,01(5) kJ/mol[8] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften


ohne und mit Ammoniakwasser
Silberchlorid ist eine weiße, mikrokristalline, lichtempfindliche Substanz mit dem Schmelzpunkt von 455 °C und einem Siedepunkt von 1550 °C.[9] In Wasser wie in Salpetersäure ist Silberchlorid schwer löslich.[10] Sein Löslichkeitsprodukt beträgt 2 ∙ 10−10 mol2/l2. Es löst sich aber sehr leicht unter Komplexbildung in Ammoniak-, Natriumthiosulfat- und Kaliumcyanidlösungen. Dabei bilden sich [Ag(NH3)2]+, [Ag(S2O3)2]3− und [Ag(CN)2]−.[9] Das Kristallgitter von Silberchlorid (ebenso wie das von Silberfluorid AgF und Silberbromid AgBr, aber nicht Silberiodid AgI) entspricht dem Kochsalzgitter.[9]
Vorkommen
Silberchlorid kommt in der Natur als das Mineral Chlorargyrit vor.[11]
Verwendung
Wird zur langfristigen Inaktivierung von Bakterien in Trinkwasserbehältern verwendet.
Im Labor wird der Silbergehalt von Proben gewichtsanalytisch (gravimetrisch) oder maßanalytisch (titrimetrisch) wegen der geringen Wasserlöslichkeit über die Ausfällung von Silberchlorid bestimmt.[9]
Silberhalogenide werden vom Licht in das entsprechende elementare Halogen und metallisches Silber zersetzt. Sie werden daher für die lichtempfindliche Schicht fotografischer Filme, Platten und Papiere verwendet.[9] Silberchlorid ist weniger lichtempfindlich als das chemisch ähnliche Silberbromid AgBr, das im Normalfall zum Fotografieren benutzt wird.
Eine für die Elektrochemie sehr wichtige Verwendung von Silberchlorid ist die in Silber-Silberchlorid-Referenzelektroden, da diese nicht polarisierbar sind und somit unverfälschte Messungen ermöglichen. Da das Quecksilber zunehmend aus Labor und Technik verbannt wird, werden die früher oft verwendeten Kalomelelektroden meist durch Ag/AgCl-Elektroden ersetzt, so dass diese inzwischen am häufigsten benutzt werden.
Die Herstellung einer solchen Elektrode kann durch elektrochemische Oxidation eines Silberdrahtes in Chlorwasserstoffsäure erfolgen: Taucht man beispielsweise zwei Silberdrähte in Salzsäure und legt eine Spannung (1–2 V, 20–300 s) an, so wird die Anode (mit dem Pluspol verbunden) mit Silberchlorid bedeckt
Bei diesem Verfahren ist sichergestellt, dass alles entstehende Silberchlorid in elektrischem Kontakt mit der Elektrode steht.
AgCl wird auch auf EKG-Elektroden als Elektrolyt verwendet.
Nachweis
Silberchlorid löst sich – im Gegensatz zu den Silberhalogeniden AgBr und AgI – in verdünnter Ammoniaklösung unter Bildung eines Komplexes:[9]
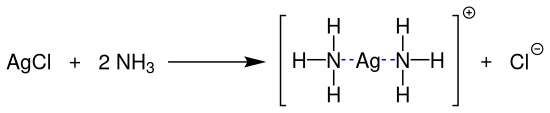
- Silberchlorid reagiert mit überschüssigem Ammoniak zu Diamminsilber(I)-Komplexionen und Chlorid-Ionen.
Auch mit Cyanid oder Thiocyanat bilden sich analoge lösliche Komplexe, so dass Silberchlorid aufgelöst wird.[9] Silberchlorid ist auch in konzentrierter Salzsäure unter Bildung des Chlorokomplexes [Cl-Ag-Cl]− zum Teil löslich, weshalb man beim Ausfällen von AgCl keinen Salzsäure-Überschuss verwenden sollte.[10]
Aus dem Amminkomplex kann beispielsweise mit Sulfid wieder unlösliches Silbersalz ausgeschieden werden:
- Diamminsilber(I)-Ionen reagieren mit Sulfid-Ionen unter der Bildung von Silbersulfid und Ammoniak.
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Crystallographic Data on Minerals, S. 4-157.
- Eintrag zu SILVER CHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- http://www.seilnacht.com/Lexikon/Chloride.htm
- Eintrag zu Silberchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-52.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Crystals, S. 10-245.
- Datenblatt Silberchlorid (PDF) bei Merck, abgerufen am 19. Januar 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, CODATA Key Values for Thermodynamics, S. 5-1.
- Wiberg, Egon., Wiberg, Nils,: Lehrbuch der anorganischen Chemie. 102., stark umgearbeitete und verb. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Jander, Gerhart, Blasius, Ewald: Jander/Blasius anorganische Chemie. 1 Einführung und qualitative Analyse : mit 21 Formeln und 79 Tabellen und Poster "Taschenfalter". 17., völlig neu bearb. Auflage. Hirzel, Stuttgart 2012, ISBN 3-7776-2134-X.
- Chlorargyrite Mineral Data. Abgerufen am 25. März 2020.

