Kaliumchlorat
Kaliumchlorat (Summenformel KClO3) ist das Kaliumsalz der Chlorsäure (HClO3).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
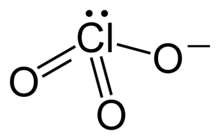 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumchlorat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | KClO3 | |||||||||||||||
| Kurzbeschreibung |
farblose, glänzende, monokline Tafeln[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 122,55 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,32 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung bei 370 °C[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kaliumchlorat ist ein weißes beständiges Salz, das in Wasser eine farblose Lösung ergibt. Die Verbindung wirkt stark oxidierend und wird unter anderem zur Herstellung von Streichhölzern, Zündhütchen und pyrotechnischen Erzeugnissen verwendet.
Herstellung
Die Gewinnung von Kaliumchlorat erfolgt durch Elektrolyse einer Natriumchlorid-Lösung und nachfolgende Fällung des entstandenen Natriumchlorats mit Kaliumchlorid. Bei der Elektrolyse sind Kathode (Stahl) und Anode (aktiviertes Titan) nicht wie bei der Chloralkalielektrolyse durch eine Membran getrennt, sondern eng aneinander gelegt. Dadurch kommt das intermediär bei der Elektrolyse gebildete Chlor in Kontakt mit der Natronlauge und bildet Natriumhypochlorit:
Dieses disproportioniert bei höherer Temperatur zu Chlorid und Chlorat:
Bei der Elektrolyse einer Kaliumchlorid-Lösung entsteht das Kaliumchlorat auf direktem Weg, wobei folgende Reaktionen ablaufen:
An der Kathode:
An der Anode:
Früher wurde Kaliumchlorat durch Einleiten von Chlor in Kaliumhydroxid-Lösung hergestellt. Es bildeten sich zunächst Kaliumchlorid und Kaliumhypochlorit zu gleichen Teilen. In der bei der Reaktion entstehenden Wärme disproportioniert das Hypochlorit zu zwei Teilen Chlorid und einem Teil Chlorat. Dabei treten im Grunde die gleichen Reaktionen auf wie bei der oben genannten Variante, allerdings werden teurere Edukte (Chlorgas und Kaliumhydroxid), aber kein Strom benötigt. Die Gesamtreaktionsgleichung lautet:
Daraus wird ersichtlich, dass in der Chloratausbeute nur ein Sechstel des eingesetzten Chlors vorhanden ist.
Eigenschaften
.jpg.webp)
Kaliumchlorat ist in kaltem Wasser schlecht, in warmem besser löslich und im Gegensatz zu Natriumchlorat nicht hygroskopisch. Es bildet beim Auskristallisieren aus wässriger Lösung strahlend glänzende und schillernde flache Kristalle. Wird es jedoch zum Beispiel durch Zugabe eines Kaliumsalzes zu einer Natriumchloratlösung ausgefällt, so entsteht es als höchst feines, weitaus weniger glänzendes Pulver. Es ist ein Oxidationsmittel, durch Erhitzen über den Schmelzpunkt disproportioniert es zu Kaliumperchlorat und Kaliumchlorid:[5]
Beim Erhitzen über 550 °C zerfällt es komplett in Sauerstoff und Kaliumchlorid. Diese Zersetzung findet bei Zugabe von Kaliumdichromat oder Mangandioxid (Braunstein) als Katalysator schon bei 150 bis 200 °C statt.[6]
Sehr brisant sind Mischungen mit oxidierbaren Stoffen wie beispielsweise Schwefel, Phosphor, Iod und Kohlenstoff, die schon durch Reibung, Stoß oder Schlag explodieren können. Die brisantesten Mischungen sind mit rotem Phosphor und gelten bei feinster Vermischung als dynamitähnlich (Armstrongsche Mischung). In der Technik werden Mengen im einstelligen Milligrammbereich daher nur nass vermischt und mit Bindemittel für Knallkorken und Zündplättchen verwendet.
- Kaliumchlorat reagiert mit Schwefel zu Kaliumchlorid und Schwefeldioxid.
- Die Reaktion von Kaliumchlorat und Kohlenstoff ergibt Kaliumchlorid und Kohlenstoffdioxid.
Bei der Reaktion mit starker Schwefelsäure ≥60 % bildet sich das gelblich-grüne Gas Chlordioxid, das bei geringer Erwärmung unter Knall in Chlor und Sauerstoff zerfällt. In Gegenwart eines Brennstoffs kommt es zur Zündung. Ein Video, das die Reaktion zeigt, ist im Abschnitt Weblinks zu finden.
- Kaliumchlorat reagiert mit Schwefelsäure zu Chlorsäure und Kaliumhydrogensulfat.
- Chlorsäure reagiert durch Autooxidation zu Chlordioxid, Perchlorsäure und Wasser.
- Chlordioxid reagiert zu Chlor und Sauerstoff.
Die maximale therapeutische, d. h. ungiftige, Dosis beträgt 1 g für einen Erwachsenen.[6] Oberhalb dessen ist es ein starkes Blut- und Nierengift. Die letale Dosis beträgt 5–15 g.[7] Eine mögliche antiseptische Wirkung wird heute meist skeptisch beurteilt und sogar angezweifelt und es darf aufgrund seiner Toxizität nur noch beschränkt eingesetzt werden.
Verwendung
Kaliumchlorat wird im Labor zur Sauerstoffgewinnung eingesetzt. Man verwendet es zur Herstellung von Leucht- und Spielzeugmunition vor allem aber in Zündköpfen von Streichhölzern.
In Feuerwerkskörpern wird es heute wenn möglich durch Kaliumperchlorat ersetzt, das sicherer in der Handhabung ist. Trotzdem ist Kaliumchlorat für bestimmte besonders farbintensive Effekte nach wie vor erforderlich.[8] Es wurde auch zur Produktion von Chloratsprengstoffen verwendet. Chloratit enthält z. B. etwa 90 % Kaliumchlorat, 10 % Kohlenwasserstoffe und einen Zusatz von Holzmehl. Diese reibungsempfindlichen Mischungen sind weitgehend durch handhabungssichere Oxidationsmittel verdrängt worden, im Besonderen durch das in Vermengung mit Brennstoffen deutlich stabilere, und mindestens ebenso effektive Kaliumperchlorat. Wird ein schwächeres Oxidationsmittel benötigt, z. B. für das Schwarzpulver in Treibladungen einer Feuerwerksrakete, oder pyrotechnische Kugel- und Zylinderbomben, wird heute meist das altbekannte Kaliumnitrat verwendet.
Nicht ungefährlich war die Verwendung für Knallerbsen, wo ein Gemisch aus Kaliumchlorat und rotem Phosphor zusammen mit Gummi arabicum zu Kügelchen geformt und danach getrocknet wurde. Die Mischung von Kaliumchlorat und rotem Phosphor ist auch unter der Bezeichnung Armstrongsche Mischung bekannt und führt immer wieder zu schweren Verletzungen beim Umgang damit, wenn die große Empfindlichkeit dieser Mixtur gegenüber Schlag, Reibung oder Elektrostatik unterschätzt wird.
Diese hochexplosive Mischung wird auch zur Zündung der Sicherheitsstreichhölzer verwendet. Hier wird sie durch das Reiben des chlorathaltigen Zündkopfes an der Reibfläche mit rotem Phosphor in Spuren frisch gebildet und entzündet den Kopf. Die Verteilung der Zündmischung auf Streichholzkopf und Reibfläche ist der entscheidende Sichherheitsvorteil dieser Konstruktion, die um 1844 vom schwedischen Chemiker Gustaf Erik Pasch erfunden wurde, denn ein solches Streichholz kann sich ohne Reibfläche kaum selbst entzünden. Auch Phosphorstreichhölzer und die noch älteren Tunkhölzer enthielten Kaliumchlorat.[6]
Generell ist Kaliumchlorat auch als Reinstoff mit Vorsicht zu behandeln, da auch geringfügige Verunreinigungen, vor allem mit rotem Phosphor, aber auch Schwefel oder Metallpulvern, die potenzielle Gefahr einer unwillkürlichen, spontanen Selbstentzündung oder Explosion maßgeblich erhöhen können.
Kaliumchlorat ist Bestandteil des „Holländischen Bades“, einer Ätzflüssigkeit für Kupferplatten aus 88 % Wasser, 10 % konz. Salzsäure und 2 % Kaliumchlorat, die für die Herstellung von Radierungen verwendet wird.
Früher wurde Kaliumchlorat eine antiseptische Wirkung zugeschrieben und es wurde deshalb in Gurgel- und Mundwässern verwendet. Diese Wirkung wird heute meist skeptisch beurteilt und sogar angezweifelt. Es gibt nur noch wenige Gurgelmittel, die Kaliumchlorat enthalten, da es aufgrund seiner Toxizität nur noch beschränkt eingesetzt werden darf.
Bei 'Kalium chloratum', welches u. A. in homöopathischen Fertigarzneimitteln, wie Salben und Globuli, als Wirkstoff benutzt wird, handelt es sich entgegen dem lateinischen Namen nicht um Kaliumchlorat, sondern um Kaliumchlorid (=KCl – auch als 'Kochsalzersatz' bekannt).
Früher wurden Natrium- und Kaliumchlorat als Unkrautvernichtungsmittel unter dem Handelsnamen UnkrautEx eingesetzt und vertrieben. Wegen des Gefahren- und Missbrauchspotenzials ist dieses aber in Deutschland schon seit mehreren Jahren nicht mehr erhältlich.
Einzelnachweise
- Eintrag zu POTASSIUM CHLORATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Kaliumchlorat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- Eintrag zu Kaliumchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Potassium chlorate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Alexander P. Hardt: Pyrotechnics. Pyrotechnica Publications, Post Falls Idaho USA 2001, ISBN 0-929388-06-2, S. 74 ff.
- Hermann Ammon (Hrsg.): Hunnius pharmazeutisches Wörterbuch. 11. Auflage, de Gruyter, Berlin 2014, ISBN 978-3-11-030990-4. Eintrag: Kaliumchlorat
- Takeo Shimizu: Fireworks — The Art, Science and Technique, Pyrotechnica Publications, Midland Texas USA, 4th Edition, S. 53 ff., S. 92 ff. ISBN 0-929388-05-4
Literatur
- John B. C. Kershaw: Die elektrolytische Chloratindustrie. Verlag von Wilh. Knapp, Halle 1905 (Reprint 2010, Survival Press)


