Transmissionselektronenmikroskop
Die Transmissionselektronenmikroskopie (TEM, steht auch für Transmissionselektronenmikroskop) ist eine Betriebsart für Elektronenmikroskope, die eine direkte Abbildung von Objekten mithilfe von Elektronenstrahlen ermöglicht. In den 1930er-Jahren wurde erstmals das Auflösungsvermögen von optischen Mikroskopen durch die bahnbrechenden Arbeiten von Max Knoll und seinem damaligen Doktoranden Ernst Ruska überschritten. Letzterer wurde 1986 mit dem Nobelpreis für Physik ausgezeichnet.[1] Die derzeitige Auflösungsgrenze liegt bei 0,045 nm.[2]

Funktionsweise
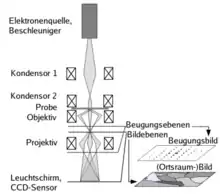

Die Elektronen durchstrahlen das Objekt, das ausreichend dünn sein muss. Je nach Ordnungszahl der Atome, aus denen das Objekt besteht, der Höhe der Beschleunigungsspannung und der gewünschten Auflösung kann die sinnvolle Objektdicke von wenigen Nanometern bis zu einigen Mikrometern reichen. Der Strahlengang verläuft im Vakuum, damit die Elektronen nicht von Luftmolekülen abgelenkt werden. Typische Beschleunigungsspannungen von TEM sind 80 kV bis 400 kV, wobei der Bereich unter 200 kV eher für die Untersuchung biologischer Materialien benutzt wird (üblicherweise benutzt man hier 80 kV bis 120 kV), während materialwissenschaftliche Aufgaben eher mit 200 kV oder höheren Spannungen gelöst werden. Die höchste benutzbare Beschleunigungsspannung ist ein wesentliches Leistungsmerkmal eines TEM. Allerdings ist die höchstmögliche Beschleunigungsspannung nicht immer die geeignetste für eine bestimmte Untersuchung.
Je höher die Ordnungszahl und je niedriger die Beschleunigungsspannung sind, desto dünner muss das Objekt sein (siehe Abschnitt „Probenaufbereitung“). Auch für hochauflösende Abbildungen ist ein dünnes Objekt erforderlich. Die von der Elektronenquelle gelieferten Elektronen werden vom Kondensor-Linsensystem so abgelenkt, dass sie den zu beobachtenden Objektabschnitt gleichmäßig ausleuchten und alle etwa parallel zueinander auf das Objekt einfallen.
In der zu untersuchenden Probe ändern die Elektronen ihre Bewegungsrichtung in Form einer Rutherford-Streuung. Teilweise verlieren sie dabei auch Bewegungsenergie (inelastische Streuung). Elastisch gestreute Elektronen, die das Objekt unter demselben Winkel verlassen, werden in der hinteren Brennebene der Objektivlinse in einem Punkt fokussiert.
Mit einer Blende (Objektivblende beziehungsweise Kontrastblende) kann man nun in dieser Ebene ausschließlich die nicht gestreuten Elektronen passieren lassen. Da Atome mit höherer Ordnungszahl sowie dickere Objektbereiche stärker streuen, wird der entstehende Kontrast Massendickenkontrast genannt. Dieser ermöglicht bei amorphen Festkörpern eine recht einfache Interpretation der erhaltenen Abbildungen.
Der Kontrast kristalliner Materialien folgt komplizierteren Gesetzmäßigkeiten und wird als Beugungskontrast bezeichnet. Da hierbei unter bestimmten Bedingungen die Bildintensität bei geringen lokalen Änderungen der Kristallstruktur (Neigung, Atomabstand), wie sie sich in der Umgebung von Kristallbaustörungen (verschiedendimensionale Defekte) durch innere Spannungen des Gitters ergeben, starke Variationen zeigt, lässt sich damit hervorragend die Realstruktur von Festkörpern untersuchen (siehe auch Abb. Versetzungslinien).
Das Projektiv-Linsensystem wirft das vom Objektiv-Linsensystem erzeugte erste Zwischenbild weiter vergrößert auf einen Detektor. Als solcher kommt beispielsweise ein Leuchtschirm zur direkten Beobachtung in Frage, der meistens mit fluoreszierendem Zinksulfid beschichtet ist. Falls das Bild aufgezeichnet werden soll, verwendet man fotografische Filme bzw. Platten (Speicherfolien) oder eine CCD-Kamera. CCD-Elemente würden durch direktes Bombardement mit den recht hochenergetischen Strahlelektronen schnell zerstört werden, daher wird die Elektronenintensität zunächst mit einem Szintillator in Licht umgesetzt, das dann über eine Transferoptik (meist Lichtleitfaserbündel) zum CCD-Chip geführt wird. Der Einsatz von Speicherfolien hat den Vorteil, dass die hochenergetische Strahlung diese nicht beschädigt und das Bild direkt aufgezeichnet werden kann. Oftmals werden Speicherfolien in der Elektronenbeugung (Diffraktion) eingesetzt.
Durch eine Änderung des Projektivlinsensystems kann anstatt des Zwischenbildes auch die Fokusebene der Objektivlinse vergrößert abgebildet werden. Man erhält so ein Elektronenbeugungsbild, mit dessen Hilfe sich die Kristallstruktur der Probe bestimmen lässt.
Ein Transmissionselektronenmikroskop kann auch für die Untersuchung der Oberflächenmorphologie von Objekten verwendet werden, die selbst für die direkte Durchstrahlung mit Elektronen zu dick sind. Statt des Originalobjektes wird ein Oberflächenabdruck untersucht. Sehr vorteilhaft ist sogar für sehr raue Oberflächen ein Kohlenstoffabdruck.
Sonderverfahren
Bei der energiegefilterten Transmissionselektronenmikroskopie (EFTEM) wird die durch den Objektdurchgang geänderte Bewegungsenergie der Elektronen ausgenutzt, um chemische Aussagen über das Objekt etwa die Verteilung der Elemente treffen zu können.
Die hochauflösende Transmissionselektronenmikroskopie (engl. High Resolution Transmission Electron Microscopy, HRTEM) ermöglicht die Abbildung der Atomanordnung in kristallinen Objekten und beruht auf dem Phasenkontrast, wobei die Kohärenz der Elektronenwelle ausgenutzt wird.
Mit dem HAADF-Signal (HAADF steht für engl. High Angle Annular Dark Field) des Raster-Transmissionselektronenmikroskops lässt sich hingegen eine inkohärente hochauflösende Abbildung erzielen. Weitere spezielle Verfahren der TEM sind z. B. Elektronenholographie, differentieller Phasenkontrast, Lorentzmikroskopie und Hochspannungsmikroskopie.

Das Beugungsbild (englisch: SAD) im TEM entsteht, ähnlich wie beim XRD, jedoch mit Elektronen und einer höheren Auflösung, sodass es möglich wird, Nanostrukturen zu beobachten. In der Probe verhalten sich die Atome wie ein Beugungsgitter und ermöglichen es, Phasenübergänge im Detail zu untersuchen. Es wird ein bestimmter Ausschnitt der Probe mit Blenden ausgewählt, um die gestreuten Elektronen aus dem Rest der Probe zu minimieren. Zudem wird der Elektronenstrahl in der Intensität reduziert, um den Sichtschirm nicht zu beschädigen oder die CCD-Kamera zu übersättigen.[3]
Die Benutzung von Graphen als Objektträger erleichtert die Ausnutzung der theoretischen Auflösung des TEM zur Abbildung einzelner Atome.[4]
Probenaufbereitung
Die wesentliche Anforderung an eine TEM-Probe ist, dass der zu untersuchende Bereich etwa 10–100 nm dick ist, für manche Untersuchungen und Proben genügen auch Dicken von einigen 100 nm.
Typische anorganische Proben
Zur Untersuchung von Metallen im TEM werden aus dem Probenmaterial zunächst Scheibchen geschnitten und auf etwa 0,1 mm Dicke geschliffen. In den meisten Fällen kann das Metall dann durch elektrolytisches Polieren so weit gedünnt werden, dass sich ein kleines Loch in der Mitte des Scheibchens bildet. Am Rand dieses Loches ist das Metall sehr dünn und mit Elektronen durchstrahlbar.
Metalle, bei denen elektrolytisches Polieren keine zufriedenstellenden Resultate liefert, sowie nicht- oder schlecht leitende Materialien wie Silizium, Keramiken oder Mineralien können durch Ionendünnung (auch Ionenstrahlätzen, engl. ion milling) transparent für Elektronen gemacht werden. Da die Abtragsrate dieses Verfahrens im Bereich von einigen Mikrometer pro Stunde liegt, werden die Proben zunächst mechanisch abgedünnt. Gebräuchlich sind hier sogenannte Dimpler, mit denen in die Mitte des Probenscheibchens eine Mulde geschliffen wird, sowie die sogenannte „Dreibeinmethode“ (engl. tripod method, der Name bezieht sich auf die Vorrichtung zum mechanischen Schleifen), bei der das Probenmaterial manuell zu einem Keil geschliffen wird.
Mit Hilfe eines Focused-Ion-Beam-Systems können Proben aus einem bestimmten Probenbereich gewonnen werden. Hierzu wird aus dem interessanten Bereich der Probe mit einem Gallium-Ionenstrahl eine Lamelle herausgeschnitten, auf einen Probenhalter transferiert („lift-out“) und soweit gedünnt, bis sie elektrontransparent wird. Bei einer anderen Methode wird die Probe zunächst mechanisch gedünnt und dann in den Rand der Probe ein transparentes Fenster gedünnt („H-bar“).
Nanopartikel, die an sich elektronentransparent sind, werden in einer Suspension auf einen ebenfalls transparenten Trägerfilm (z. B. amorpher Kohlenstoff, eventuell auch mit kleinen Löchern darin) aufgetragen. Beim Abtrocknen der Suspension bleiben die Partikel an dem Film haften. Bei der Untersuchung werden dann entweder sowohl der Trägerfilm als auch ein Partikel durchstrahlt, oder aber es gelingt, Partikel zu finden, die am Trägerfilm haften, jedoch frei über einem Loch liegen; in diesem Fall stört der Trägerfilm die Untersuchung überhaupt nicht.
Auf ähnliche Weise können auch Metalle untersucht werden. Dazu wird die Probe mit einem dünnen Kohlenstofffilm überzogen, der dann durch Ätzen abgelöst wird. Die resultierende Replik gibt nicht nur die Topografie der Probe wieder, sondern bei entsprechender metallografischer Vorbereitung bleiben auch nichtmetallische Einschlüsse und Ausscheidungen daran haften.
Biologische Proben
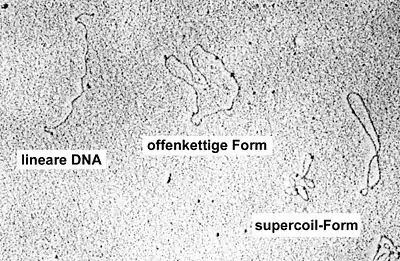
Biologische Proben, die im TEM betrachtet werden sollen, müssen eine Reihe von Vorbereitungen durchlaufen. Dabei hängt es von der wissenschaftlichen Fragestellung ab, welche Methode verwendet wird. Für die hochauflösende Strukturanalyse von Biomolekülen in Lösung mittels Kryoelektronenmikroskopie wurde 2017 der Nobelpreis für Chemie vergeben.[5]
- Fixierung – um die Probe realistischer darstellen zu können. Verwendet werden Glutaraldehyd zur Vernetzung und damit Verhärtung der Proteine und Osmiumtetroxid, welches Lipide schwarz färbt und gleichzeitig fixiert.
- Cryo-Fixierung – die Probe wird in flüssigem Ethan bei weniger als −135 °C schockgefroren. Dabei kristallisiert das Wasser nicht, sondern bildet vitrifiziertes (glasartiges) Eis. Bei dieser Methode wird die biologische Probe mit der geringsten Artefaktbildung fixiert. Allerdings ist der Kontrast sehr gering.
- Dehydratisierung – Wasser wird entfernt und schrittweise durch Ethanol oder Aceton ersetzt.
- Einbettung – um Gewebe sektionieren zu können. Hierzu werden meist Acrylharze genutzt.
- Sektionierung – Aufteilen der Probe in dünne Scheiben (Ultradünnschnitte). Diese können auf einem Ultra-Mikrotom mit einer Diamant- oder Glasklinge geschnitten werden.
- Immungoldfärbung – Gelegentlich wird mit Goldpartikeln markierten Antikörpern einzelne Epitope angefärbt.
- Negativkontrastierung (Negative Stain) – Schwere Atome wie Blei- oder Uran-Atome streuen Elektronen stärker als leichte Atome und erhöhen so den Kontrast (Massendickenkontrast). Hier werden Reagenzien wie Uranylacetat, Osmiumtetroxid, Rutheniumtetroxid, Wolframatophosphorsäure oder Bleicitrat verwendet.
- High-Pressure Freezing (HPF) – bei dieser Methode werden sehr kleine Probenmengen unter hohem Druck schockgefroren. Diese Methode eignet sich besonders für die Immun-Elektronenmikroskopie, da die Oberflächenstruktur der Probe nur minimal verändert wird.
Siehe auch
Weblinks
- ETH Zürich: electron microscopy sehr gute Grafiken und Abbildungen, die verschiedene Verfahren illustrieren
- Dartmouth College: Dartmouth Electron Microscope Facility Zahlreiche biologische Präparate in hoher Auflösung
Quellen
- Informationen der Nobelstiftung zur Preisverleihung 1986 an Ernst Ruska
- Hidetaka Sawada, Naoki Shimura, Fumio Hosokawa, Naoya Shibata and Yuichi Ikuhara: Resolving 45-pm-separated Si-Si atomic columns with an aberration-corrected STEM. 2015, abgerufen am 16. November 2016 (englisch).
- Carter, C. Barry.: Transmission electron microscopy: a textbook for materials science. 2nd ed Auflage. Springer, New York 2009, ISBN 978-0-387-76501-3.
- Durchbruch dank Graphen – idealer Objektträger für TEM. In: Spektrum der Wissenschaft. Nr. 1, 2009, S. 21–22.
- The Nobel Prize in Chemistry 2017. Abgerufen am 4. Oktober 2020 (amerikanisches Englisch).