Stereochemie
Die Stereochemie ist ein Teilgebiet der Chemie, das im Wesentlichen zwei Aspekte behandelt:
- die Lehre vom dreidimensionalen Aufbau der Moleküle, die die gleiche chemische Bindung und Zusammensetzung, aber eine verschiedene Anordnung der Atome aufweisen, wobei die Konstitution, Konfiguration und Konformation den dreidimensionalen Aufbau des Moleküls bestimmen (stereochemische Isomerie)
- die Lehre vom räumlichen Ablauf chemischer Reaktionen stereoisomerer Moleküle (stereochemische Dynamik).
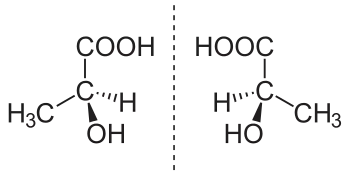
Das Studium stereochemischer Phänomene erstreckt sich auf das gesamte Gebiet der organischen, anorganischen, physikalischen und supramolekularen Chemie sowie der Biochemie.
Geschichtliche Entwicklung

Nach Entwicklung der Atomtheorie von John Dalton gingen die Überlegungen dahin, wie die Atome räumlich angeordnet sein könnten. Bereits 1808 postulierte William Hyde Wollaston für Verbindungen des Typs AB4 eine tetraedrische Anordnung. Ausführlich beschäftigte sich auch André-Marie Ampère 1814 mit der dreidimensionalen Anordnung von Atomen in Molekülen insbesondere in Kristallen, wobei er unterschiedliche Formen durch das Ineinanderschieben von Tetraedern und Oktaedern erklärte. Leopold Gmelin entwickelte in den 1840er Jahren eine Kerntheorie für die Struktur von organischen Verbindungen. Danach war „Äthen“ der Stammkern mit einem kubischen Aufbau, von dem sich andere Verbindungen ableiteten. Zumindest regte er mit seiner Theorie weitere ernsthafte Auseinandersetzungen mit der räumlichen Struktur organischer Verbindungen an.
Louis Pasteur gelang 1848 die erste Racematspaltung durch Sortierung enantiomerer Kristalle des Weinsteins. Pasteur vermutete auch als Erster, dass das Phänomen der optischen Drehung, die von Jean-Baptiste Biot 1813 entdeckt wurde, auf das Vorliegen spiegelbildlicher Moleküle zurückzuführen sei.
Sowohl Archibald Scott Couper als auch Friedrich August Kekulé postulierten 1858, dass auch Kohlenstoffatome untereinander verknüpft sein könnten und stellten entsprechende Formeln auf, die den heutigen Konstitutionsformeln schon sehr ähnlich waren.
Die nach 1865 einsetzende Diskussion über die Formel von Benzol war stereochemischer Natur, weil hierbei auch dreidimensionale Strukturen Berücksichtigung fanden. Johannes Wislicenus beschäftigte sich in den 1860er Jahren mit Milchsäureisomeren, deren optischer Aktivität und dreidimensionalen Aufbau.[1]
Die eigentliche Lehre von der räumlichen Anordnung der Atome wurde 1874 von van't Hoff und Joseph Le Bel angeregt und basiert auf drei im 19. Jahrhundert entwickelten Erkenntnissen der Atomtheorie und der tetraedischen Bindung des Kohlenstoffs, der Strukturtheorie der chemischen Bindung und der optischen Drehung. So knüpfte van’t Hoff an die von Emil Erlenmeyer und Johannes Wislicenus geführte Diskussion über die Konstitution von Milchsäure an. Im Weiteren schlug er unterschiedliche Strukturformeln für isomere Verbindungen (Kohlenwasserstoffe, Alkohole, organische Säuren) mit asymmetrischen Kohlenstoffatomen vor, wobei das Tetraedermodell hierbei eine wichtige Grundlage bildete. Er entwickelte auch eine Vorstellung der Doppelbindung zwischen Kohlenstoffatomen, bei der zwei Tetraeder eine gemeinsame Kante aufweisen.[2]
Einen weiteren Meilenstein stellen die Arbeiten Emil Fischers zur Struktur der Kohlenhydrate und die Beschreibung deren Stereochemie durch die Fischer-Projektion dar. Die Arbeiten Fischers wurden 1902 mit dem Nobelpreis für Chemie ausgezeichnet.
Alfred Werners Studien zur Stereochemie von Koordinationsverbindungen des Kobalts, die 1913 ebenfalls mit dem Nobelpreis für Chemie ausgezeichnet wurden, können zugleich auch als Beginn der Komplexchemie angesehen werden.
Auch Vladimir Prelogs Forschungen über die Stereochemie organischer Moleküle und Reaktionen wurden 1975 mit dem Nobelpreis ausgezeichnet.[3] Die von ihm mitentwickelte Cahn-Ingold-Prelog-Konvention dient zur stereochemischen Beschreibung von organischen Molekülen.
Isomerie
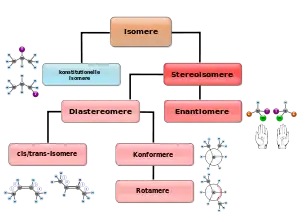
Isomerie liegt vor, wenn Moleküle bei gleicher Summenformel verschiedene räumliche Strukturen aufweisen können. Die Konformationsisomerie beruht auf der Drehung um eine Einfachbindung eines Moleküls, so dass die Substituenten der über die Einfachbindung verknüpften Atome zueinander verschiedene Positionen einnehmen können. Moleküle die sich nur in dieser spezifischen Anordnung der Atome unterscheiden werden als Konformere bezeichnet. Spiegelbildisomerie tritt bei chemischen Verbindungen auf, die sich zu einem Gegenstück verhalten wie dessen Spiegelbild. Die entsprechenden chemischen Verbindungen werden Enantiomere oder optische Antipoden genannt. Diese Art der Isomerie kann auf einem Stereozentrum, einer chiralen Achse oder auf planarer oder helicaler Chiralität beruhen. Aus der Gruppentheorie ergibt sich, dass die Abwesenheit einer Drehspiegelachse die notwendige und ausreichende Bedingung für das Auftreten von Enantiomeren ist. Diastereomerie liegt vor, wenn bei Molekülen mit mehreren Stereozentren diese zum Teil in der gleichen und teilweise in verschiedenen Konfigurationen vorliegen.
Funktionsisomerie liegt vor, wenn Moleküle bei gleicher Summenformel unterschiedliche funktionelle Gruppen aufweisen. Als Skelettisomerie bezeichnet man das Vorliegen von verschiedenen Gerüsten. Stellungsisomerie tritt bei Molekülen auf, bei denen gleiche funktionelle Gruppe an verschiedenen Positionen im Gerüst auftreten. Die cis-trans-Isomerie oder (Z)-(E)-Isomerie ist eine Sonderform der Stellungsisomerie. Sie tritt auf bei Verbindungen, bei denen zwei oder mehr hinsichtlich der Stellung von Substituenten bezüglich einer Referenzebene unterscheiden. Als Bindungsisomerie oder Valenzisomerie bezeichnet man das Vorkommen von verschiedener Anzahl σ- und π-Bindungen in Molekülen.
Stereochemische Begriffe
Symmetrieeigenschaften und -operationen
Die Stereochemie behandelt die Symmetrieeigenschaften von Molekülen. Die Molekülsymmetrie kann Symmetrieachsen aufweisen, ein Symmetriezentrum oder eine Symmetrieebene. Es gibt vier fundamentale Symmetrieoperationen, die Spiegelung, die Rotation und die Inversion, sowie bei Festkörpern die Translation.
Symmetrieachse Cn
Die Symmetrie- oder Drehachse[4] beschreibt eine Achse im Molekül, bei der durch Rotation des Moleküls um den Drehwinkel 360°/n die neue Anordnung der Atome im Molekül mit der vorherigen deckungsgleich ist. Ein Beispiel für ein Molekül der Punktgruppe C2 ist das Wasser, ein Beispiel für die Punktgruppe C3 ist das Ammoniak. Das Benzol weist sowohl eine C2-Achse als auch eine C6-Achse auf.
Symmetrieebene σ
Die Symmetrie- oder Spiegelebene[5] beschreibt eine Ebene im Molekül, welches das Molekül in zwei symmetrisch übereinstimmende Hälften teilt. Je nachdem, wo die Symmetrieebene im Molekül liegt, unterscheidet man Ebenen entlang der Hauptachse des Moleküls, bezeichnet als σv (von vertikal). Verläuft die Ebene senkrecht zur Hauptachse des Moleküls wird diese als σh bezeichnet (von horizontal), Ebenen, die diagonal verlaufen, werden σd genannt.
Inversionszentrum i
Ein Inversions- oder Symmetriezentrum überführt alle Atome durch Spiegelung an einem zentralen Punkt in symmetrieäquivalente Atome. Moleküle mit einem Inversionszentrum sind unpolar. Bei geradzahligen Molekülen liegt das Inversionszentrum nicht auf einem Atom des Moleküls, zum Beispiel beim Benzol, bei ungeradzahligen Molekülen fällt das Inversionszentrum auf ein Atom, zum Beispiel das Kohlenstoffatom bei Kohlenstoffdioxid.
Drehspiegelachse Sn
Eine Drehspiegelachse überführt die Atome in einem Molekül durch eine Drehung um einen Winkel von 360°/n und anschließende Spiegelung in symmetrieäquivalente Atome. Die Spiegelebene steht dabei senkrecht zur Drehachse. Das Symmetrieelement S1 entspricht einer Symmetrieebene σ, das Symmetrieelement S2 entspricht einem Inversionszentrum i.
Siehe auch
- Absolute Konfiguration
- Axiale Chiralität
- Baeyer-Spannung
- Chiralität
- Cis-trans-Isomerie
- Diastereomere
- Diederwinkel
- Enantioselektive Synthese
- Helicale Chiralität
- In-Out-Isomerie
- Konfiguration (Chemie)
- Konformere
- Konstitution (Chemie)
- Mutarotation
- Optische Aktivität
- Planare Chiralität
- Punktgruppe
- Primärstruktur
- Racemat
- Selektivität (Chemie) / Regioselektivität
- Stereoselektive Synthese
- Valenzisomere
- Walden-Umkehr
Einzelnachweise
- Kurt Hermann: Stereochemie vor van’t Hoff und Le Bel. In: Chemie in unserer Zeit. Band 8, Nr. 5, 1974, S. 129–134, doi:10.1002/ciuz.19740080502.
- Otto Krätz: Das Porträt: Jacobus Henricus van’t Hoff 1852–1911. In: Chemie in unserer Zeit. Band 8, Nr. 5, 1974, S. 135–142, doi:10.1002/ciuz.19740080503.
- Nobelpreisvortrag von Prelog (PDF; 663 kB)
- Drehachsen Cn
- Karl-Heinz Hellwich: Stereochemie: Grundbegriffe, S. 96 (eingeschränkte Vorschau in der Google-Buchsuche).
Literatur
- Kurt Mislow: Einführung in die Stereochemie, Verlag Chemie, Weinheim 1972 (Nachdruck der 1. Auflage von 1967), ISBN 3-527-25196-0.
- Ernest L. Eliel: Die Entwicklung der Stereochemie seit Le Bel und van’t Hoff. In: Chemie in unserer Zeit. Band 8, Nr. 5, 1974, S. 148–158, doi:10.1002/ciuz.19740080505.
- Hermann J. Roth, Christa E. Müller, Gerd Folkers: Stereochemie & Arzneistoffe, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 1998, ISBN 3-8047-1485-4.
- Bernhard Testa: Grundlagen der Organischen Stereochemie. Verlag Chemie, Weinheim, 1983, ISBN 3-527-25935-X.
- Jost Weyer: Hundert Jahre Stereochemie – Ein Rückblick auf die wichtigsten Entwicklungsphasen. In: Angewandte Chemie. Band 86, Nr. 17, 1974, S. 604–611, doi:10.1002/ange.19740861702.
- Ernest L. Eliel, S. H. Wilen: Organische Stereochemie, Verlag Wiley–VCH, Weinheim 1998, ISBN 3-527-29349-3.
- Adam Sobanski, Roland Schmider, Fritz Vögtle: Topologische Stereochemie und Chiralität. In: Chemie in unserer Zeit. Band 34, Nr. 3, 2000, S. 160–169, doi:10.1002/1521-3781(200006)34:33.0.CO;2-6.