Osmium(IV)-oxid
Osmium(IV)-oxid ist eine anorganische chemische Verbindung des Osmiums aus der Gruppe der Oxide.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
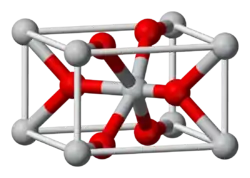 | |||||||||||||
| _ Os4+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Osmium(IV)-oxid | ||||||||||||
| Andere Namen |
Osmiumdioxid | ||||||||||||
| Verhältnisformel | OsO2 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 222,20 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
11,4 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Osmium(IV)-oxid kann durch Reduktion von Osmiumtetroxid in einem Wasserstoff-Stickstoff-Gasstrom oder durch Reaktion von Kaliumhexachloroosmat K2OsCl6 mit Natriumcarbonat bei hohen Temperaturen gewonnen werden.[4]
Einkristalle des Oxides lassen sich durch eine CVT-Methode (Chemical Vapor Transport) herstellen. Hierfür wird zunächst elementares Osmium mit Natriumchlorat in einer abgeschmolzenen und evakuierten Ampulle in einer 2-Stufen-Umsetzung bei zunächst 300 °C und dann 650 °C zum polykristallinen Oxid umgesetzt. Die Ampulle mit dem Oxid wird dann in einen 2-Zonen-Ofen eingebracht, sodass je die Hälfte der Ampulle in einer der Zonen liegt. Während die eine Hälfte der Ampulle auf 960 °C aufgeheizt wird, wird die andere bei 900 °C gehalten. Nach 2 Tagen Reaktionszeit (bei anfänglich eingesetzten 0,15 g elementarem Osmium) lässt man die Ampulle abkühlen und erhält nach dem Öffnen etwa 2 mm große goldene Einkristalle der Zielverbindung.[2]
Eigenschaften
Osmium(IV)-oxid ist gekauft ein schwarzer Feststoff, der unlöslich in Wasser ist[1], während die frisch hergestellte Verbindung sowohl in poly- als auch einkristalliner Form eine goldene Farbe aufweist.[2] Es geht an Luft langsam in Osmiumtetroxid über und kann pyrophor mit Luftsauerstoff reagieren. Es besitzt eine Kristallstruktur vom Rutiltyp (a = 451 pm, c = 319 pm). Das Dihydrat ist ein tiefschwarzes Pulver, das wie das Anhydrat zur Osmiumtetroxid-Bildung an Luft neigt. In Salzsäure ist es löslich zu Dihydrogenhexachloroosmat H2[OsCl6].[4]
Einzelnachweise
- Datenblatt Osmium(IV) oxide, Os 83% min bei AlfaAesar, abgerufen am 1. September 2013 (PDF) (JavaScript erforderlich).
- D. B. Rogers et al.: Single crystals of transition-metal dioxides - B. Osmium dioxide. In: F. A. Cotton (Hrsg.): Inorganic Syntheses. Band 13. McGraw-Hill Book Company, Inc., 1972, ISBN 07-013208-9 (defekt), S. 135–145 (englisch).
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 646 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1745.
