Quartäre Ammoniumverbindungen
Quartäre Ammoniumverbindungen, gelegentlich auch QAV, Quats oder falsch quaternäre Ammoniumverbindungen genannt, sind organische [Ammonium]-verbindungen, bei denen an alle vier Valenzen des Stickstoffatoms organische Reste gebunden sind. Es handelt sich somit um Salze, also um ionische Verbindungen, die aus einem Kation und einem Anion bestehen. Es gibt den Amin-Typ NR4+X−, bei dem alle vier R organische Reste sind, und den Imin-Typ R=NR2+X−; wobei X− das zugehörige Anion ist. Auch N-alkylierte Heteroaromaten gehören zu den quartären Ammoniumverbindungen.
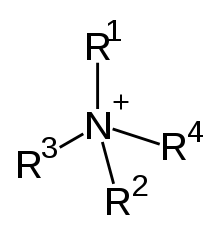 Alkylammonium-Verbindung (Kation). Das zugehörige Anion ist nicht abgebildet. |
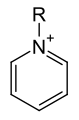 Pyridinium-Verbindung (Kation). Das zugehörige Anion ist nicht abgebildet. |
Herstellung
Quartäre Ammoniumverbindungen werden durch Umsetzung von Aminen mit Alkylierungsmitteln, wie z. B. Methylchlorid, Benzylchlorid, Dimethylsulfat, Dodecylbromid oder Ethylenoxid im Überschuss hergestellt.[1]
Diese Art der Alkylierung wird erschöpfende Alkylierung genannt.
Tertiäre Amine werden bei Erhitzung mit Alkylhalogeniden leicht in ein quartäres Amin umgesetzt. Die Reaktion verläuft nach folgender Gleichung:[2]
Es existieren drei verschiedene Typen von QAV und deren Untergruppen, nämlich:
- lineare Alkylammonium-Verbindungen
- Alkyltrimethylammoniumsalze, z. B. Cetyltrimethylammoniumbromid
- Dialkyldimethylammoniumsalze
- Benzalkoniumsalze, z. B. Benzalkoniumchlorid
- Esterquats
- Ethoxylierte QAV
- Organobentonit
- Imidazolium-Verbindungen
- Pyridinium-Verbindungen
Eigenschaften
Quartäre Ammoniumverbindungen sind feste ionische Produkte. Sie sind gut in Wasser löslich; in vielen organischen Lösungsmitteln wie beispielsweise Diethylether dagegen unlöslich. Mit Alkali bilden sie im Gegensatz zu den Hydrohalogeniden der Amine kein freies Amin, sondern ein stabiles quartäres Ammoniumhydroxid. Diese Reaktion ist eine Gleichgewichtsreaktion, die sehr stark zur Hydroxidseite verschoben ist. Die quartären Ammoniumhydroxide sind starke Basen, vergleichbar mit Natriumhydroxid und Kaliumhydroxid.[3]
Quartäre Ammoniumverbindungen sind thermisch instabil und schwer schmelzbar; beim Erhitzen zerfallen sie in das tertiäre Amin und das Alkylhalogenid. Beispielsweise zerfällt das in Wasser gelöste Tetramethylammoniumhydroxid beim Eindampfen zu Trimethylamin und Methanol entsprechend der Reaktionsgleichung:
Diese leichte thermische Spaltung wurde bereits 1851 von August Wilhelm von Hofmann bemerkt und für zwei allgemein anwendbare Arbeitsmethoden benutzt:[4]
Mit der ersten Methode wurden Strukturaufklärungen von Aminen durchgeführt. Hierfür wurden zuerst von den fraglichen Aminen alle Wasserstoffatome der Aminogruppe durch Methylgruppen mit der erschöpfenden Methylierung ersetzt. Nach der Umwandlung der resultierenden quartären Halogenammoniumverbindungen in das Hydroxid, wurde letzteres thermisch durch Pyrolyse zersetzt. Je nachdem ob eine, zwei oder drei Methylgruppen eingebaut worden waren, entsprach dies primären, sekundären oder tertiären Aminen.
Bei der zweiten Methode wird die Eigenschaft der QAV benutzt, dass die Methylgruppe wesentlich stärker an den Amin-Stickstoff gebunden wird als Alkylgruppen mit mehr C-Atomen. Bei der Pyrolyse wird kein Alkohol vergleichbar zu Methanol gebildet, sondern neben Trimethylamin und Wasser auch ein Alken. Diese Reaktion ist grundsätzlich für die Darstellung von Alkenen geeignet. Die Reaktionsgleichung für die Umsetzung lautet:
Verwendung
QAV mit mindestens einer langen Alkylgruppe haben oberflächenaktive Eigenschaften und werden als kationische Tenside in Produkten wie Weichspülern, als Invertseifen oder als Antistatika (z. B. in Shampoos) eingesetzt. Aufgrund ihrer Desinfektionswirkung werden sie auch zu den Bioziden gezählt. Im öffentlichen und industriellen Bereich finden sie in Krankenhäusern, bei der Lebensmittelverarbeitung, in der Landwirtschaft, im Holzschutz und in der Industrie Verwendung (Reinraumapplikationen). Quats sind in der Regel der Hauptwirkstoff in Antialgenmitteln (Algiziden) für Schwimmbäder und Pools, sowie in Algen-, Moos- und Schimmel-entfernern zur Reinigung von Fassaden und der Witterung ausgesetzten Textilien wie Zelten, Markisen und Sonnenschirmen. Zudem werden QAV in der organischen Synthese als Phasentransferkatalysatoren eingesetzt.
Zu den QAV gehören beispielsweise:
- Benzalkoniumchlorid
- Cetylalkoniumchlorid
- Cetylpyridiniumchlorid
- Cetyltrimethylammoniumbromid
- Denatoniumbenzoat
- Dimethyldioctadecylammoniumchlorid
- Tetramethylammoniumhydroxid (TMAH)
- Tetrabutylammoniumhydroxid (TBAH)
- Paraquat
- Polyquaternium-7
- Tetradecyltrimethylammoniumoxalat
- 3-Chlor-2-hydroxypropyl-N,N,N-trimethylammoniumchlorid
- Benzyltrimethylammoniumchlorid
QAV haben neuerdings auch Bedeutung als ionische Flüssigkeiten erlangt.
Ein weiterer Anwendungsbereich für QAV ist die Wasseraufbereitung, wo sie als stark basische Ionenaustauscher für die Erzeugung von demineralisiertem Wasser eingesetzt werden. Der Typ I dieser Anionenaustauscher ist eine Trimethyl-benzylammonium-Verbindung. Dieser Typ I ist thermisch stabiler als die Austauscher des Typs II, bei denen mindestens eine der drei Methylgruppen ( –N+(CH3)3 ) des quartären Amins durch eine Ethylgruppe ( –CH2–CH2–OH ) ersetzt ist.[5]
Biologische Bedeutung
QAV reichern sich in Zellmembranen lebender Organismen an und können so die Funktion der Zellmembran beeinträchtigen. Dank dieser Wirkung können insbesondere die kationischen Tenside auch als Desinfektionsmittel eingesetzt werden. Die mikrobizide Wirkung ist nur dann gegeben, wenn die am N-Atom gebundene Alkylgruppe eine Kettenlänge von 8 bis 18 C-Atomen aufweist. Viele quartäre Ammoniumverbindungen werden in Kläranlagen durch Adsorption an den Klärschlamm größtenteils eliminiert.[6][7] Vom Gebrauch QAV-haltiger Bad- und WC-Reiniger wird abgeraten.[8] Als Hauptquellen für das Vorkommen im Abwasser wurden Krankenhäuser und Wäschereien ausgemacht.[7] Wegen ihrer deutlich besseren biologischen Abbaubarkeit, wurden in den letzten Jahren einige QAV durch Esterquats ersetzt.[9]
Natürliches Vorkommen

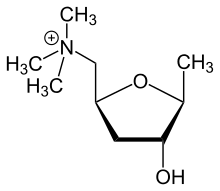
Cholin kommt als Substanz oder chemisch gebunden in zahlreichen Organismen vor. Acetylcholin, der Essigsäureester des Cholins, ist ein wichtiger Neurotransmitter. Betain ist ein Oxidationsprodukt des Cholins und spielt eine Rolle in Transmethylierungsprozessen.
Der Fliegenpilz enthält L-(+)-Muscarin, einen giftigen Naturstoff, der zu den quartären Ammoniumverbindungen zählt. Die in Pflanzen der Gattung Chondrodendron vorkommende quartäre Ammoniumverbindung D-Tubocurarin ist Bestandteil des Curare-Pfeilgiftes.
Die Alkaloide Sanguinarin, Chelerythrin (z. B. im Schöllkraut vorkommend) und Berberin (z. B. in der Berberitze) weisen aufgrund ihrer quartären Struktur eine kräftige rote bzw. gelbe Farbe auf.
In jüngerer Zeit kam es zu Rückstandsbefunden von QAV, insbesondere BAC (Benzalkoniumchlorid) und DDAC (Didecyldimethylammoniumchlorid) auf frischem Obst und Gemüse sowie in Pflanzenstärkungsmitteln.[10]
Nomenklatur
Neben der offiziellen IUPAC-Nomenklatur werden für die Bezeichnung quartärer Ammoniumverbindungen, besonders mit langen Alkylketten, häufig die Trivialbezeichnungen der Alkylgruppen verwendet.
Nach der IUPAC-Systematik werden die Namen dieser Verbindungen vom Azanium-Ion abgeleitet.[11]
Siehe auch
Literatur
- Chang Zhang, Fang Cui, Guang-ming Zeng, Min Jiang, Zhong-zhu Yang, Zhi-gang Yu, Meng-ying Zhu, Liu-qing Shen: Quaternary ammonium compounds (QACs): A review on occurrence, fate and toxicity in the environment. In: Science of the Total Environment 518–519, 2015, S. 352–362, doi:10.1016/j.scitotenv.2015.03.007.
Weblinks
- Quartäre Ammoniumverbindungen – Informationen des CVUA Freiburg
Einzelnachweise
- Eintrag zu Quartäre Ammoniumverbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- L. F. Fieser / M. Fieser; In: Lehrbuch der Organischen Chemie; Verlag Chemie, Weinheim/Bergstr.; 3. Auflage, 1957, S. 248.
- L. F. Fieser / M. Fieser; In: Lehrbuch der Organischen Chemie; Verlag Chemie, Weinheim/Bergstr.; 3. Auflage, 1957, S. 249.
- L. F. Fieser / M. Fieser; In: Lehrbuch der Organischen Chemie; Verlag Chemie, Weinheim/Bergstr.; 3. Auflage, 1957, S. 260.
- G. Kühne und F. Martinola; In: Ionenaustauscher – ihre Beständigkeit gegen chemische und physikalische Einwirkungen; VGB Kraftwerkstechnik, 57, Heft 3, März 1977, S. 176.
- Chang Zhang, Fang Cui, Guang-ming Zeng, Min Jiang, Zhong-zhu Yang, Zhi-gang Yu, Meng-ying Zhu, Liu-qing Shen: Quaternary ammonium compounds (QACs): A review on occurrence, fate and toxicity in the environment. In: Science of the Total Environment 518–519, 2015, S. 352–362, doi:10.1016/j.scitotenv.2015.03.007.
- Gans O. et al. (2005): Grundlagen zur Risikoabschätzung für quaternäre Ammoniumverbindungen (PDF; 1,3 MB). Umweltbundesamt, Wien.
- Nadine Woodtli: «Kassensturz»-Test - Die Chemiekeule im Putzschrank. In: srf.ch. 26. November 2019, abgerufen am 27. November 2019.
- S. Mishra, V. K. Tyagi: Esterquats: the novel class of cationic fabric softeners. In: Journal of Oleo Science. Band 56, Nummer 6, 2007, S. 269–276, PMID 17898491 (Review).
- Kontamination von Lebensmitteln durch Desinfektionsmittel.
- G. J. Leigh (Hrsg.): Principles of chemical nomenclature. A guide to IUPAC recommendations. The Royal Society of Chemistry, Cambridge 2011, S. 46.