Caesiumperchlorat
Caesiumperchlorat ist eine anorganische chemische Verbindung des Caesiums aus der Gruppe der Perchlorate.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
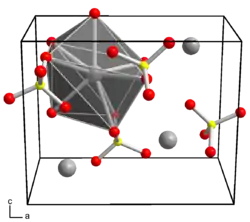 | ||||||||||||||||
| _ Cs+ _ Cl7+ _ O2− | ||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Caesiumperchlorat | |||||||||||||||
| Andere Namen |
Perchlorsäure Caesiumsalz | |||||||||||||||
| Verhältnisformel | CsClO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 232,36 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
3,327 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
schlecht löslich in Wasser (2 g·l−1 bei 25 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Caesiumperchlorat kann durch thermische Zersetzung von Caesiumchlorat gewonnen werden, wobei die Zersetzung auf zwei parallelen Wegen stattfindet. Da Caesiumperchlorat bei Temperaturen um den Schmelzpunkt von Caesiumchlorat noch stabil ist, reichert es sich bei der Zersetzung zusammen mit Caesiumchlorid an.[4]
Eigenschaften
Caesiumperchlorat ist ein weißer Feststoff, der schlecht löslich in Wasser ist.[2] Die Verbindung kristallisiert isostrukturell zu Bariumsulfat in der orthorhombischen Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterkonstanten a = 9,832(1) Å, b = 6,009(1) Å, c = 7,764(2) Å.[1]
| Temperature (°C) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|
| Löslichkeit (g/100 ml) | 0,1 | 1,0 | 1,6 | 2,6 | 4,0 | 7,3 | 14,4 | 30,0 |
Bei Erhitzung beginnt es ab etwa 220 °C sich zu zersetzen, wobei es sich bei höheren Temperaturen vollständig zu Caesiumchlorid und Sauerstoff zersetzt.[4]
Verwendung
Caesiumperchlorat wird für optische Spezialgläser verwendet.[6]
Es kann auch zur Herstellung anderer chemischer Verbindungen wie Chlorperchlorat verwendet werden.[7]
Einzelnachweise
- J. Granzin: Refinement of the crystal structures of RbClO4 and CsClO4. In: Zeitschrift für Kristallographie. Band 184, Nr. 1–4, November 1988, S. 157–160, doi:10.1524/zkri.1988.184.14.157.
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 113 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Cesium perchlorate, 99.995% trace metals basis bei Sigma-Aldrich, abgerufen am 17. Oktober 2015 (PDF).
- Kurt H. Stern: High Temperature Properties and Thermal Decomposition of Inorganic Salts ... CRC Press, 2000, ISBN 1-4200-4234-3, S. 195 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. W. Mullin: Crystallization. Butterworth-Heinemann, 2001, ISBN 978-0-08-053011-6, S. 484 (eingeschränkte Vorschau in der Google-Buchsuche).
- Loran O'Bannon: Dictionary of Ceramic Science and Engineering. Springer Science & Business Media, 2012, ISBN 978-1-4613-2655-7, S. 56 (eingeschränkte Vorschau in der Google-Buchsuche).
- James E. House, Kathleen A. House: Descriptive Inorganic Chemistry. Academic Press, 2015, ISBN 978-0-12-802979-4, S. 280 (eingeschränkte Vorschau in der Google-Buchsuche).
