tert-Butanol
tert-Butanol (nach IUPAC-Nomenklatur: 2-Methylpropan-2-ol, auch als tert-Butylalkohol bekannt) ist eine organisch-chemische Verbindung und einfachster Vertreter der Stoffgruppe der tertiären Alkohole.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
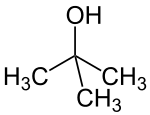 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | tert-Butanol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H10O | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit kampherartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 74,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
0,79 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
83 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 20 ml·m−3 bzw. 60 mg·m−3[4] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Natürlich kommt tert-Butanol unter anderem in Ingwer (Zingiber officinale)[5] und Guave (Psidium guajava)[6] vor.
 Guave
Guave Ingwerknollen
Ingwerknollen
Gewinnung und Darstellung
Die großtechnische Herstellung von tert-Butanol erfolgt durch säurekatalysierte Hydratisierung von Isobuten bei Temperaturen von 30–120 °C und Drücken von 5–12 bar. Als Katalysator werden vorwiegend saure Ionentauscherharze verwendet.[7]

Diese Reaktion liefert ausschließlich das tert-Butanol und nicht das isomere Isobutanol, da – nach der Regel von Markovnikov – immer das thermodynamisch stabilste Carbeniumion (hier: tert-Butylkation) gebildet wird.
Eigenschaften
Physikalische Eigenschaften
2-Methyl-2-propanol ist ein bei knapp über Raumtemperatur schmelzender, fester, farbloser Stoff, der charakteristisch campherartig riecht. Als Feststoff tritt die Verbindung in drei polymorphen Kristallformen auf.[8] Bei einer Temperatur von 13 °C wandelt sich die Kristallform II mit einer Umwandlungsenthalpie von 0,828 kJ·mol−1 in die Kristallform I um.[8] Diese schmilzt dann bei 26 °C mit einer Schmelzenthalpie von 6,703 kJ·mol−1.[8] Eine weitere metastabile Kristallform III zeigt bei 21 °C eine Umwandlung zur Kristallform I mit einer Umwandlungsenthalpie von 0,490 kJ·mol−1.[8]
Die Verbindung bildet mit einer Reihe anderer Lösungsmittel azeotrop siedende Gemische.[9]
Azeotrope mit verschiedenen Lösungsmitteln[9] Lösungsmittel Wasser n-Hexan n-Heptan Cyclohexan Benzol Gehalt tert.-Butanol in Mol% 64,6 24,7 68,8 40,0 37,8 Siedepunkt in °C 79 64 78 71 74 Verdampfungsenthalpie in kJ·mol−1 37,92 33,28 38,40 35,52 35,53
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,49774, B = 1174,869 und C = −93,92 im Temperaturbereich von 312,66 bis 355,56 K.[10] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−αTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 69,085 kJ/mol, α = −0,3583, β = 0,678 und Tc = 506,2 K im Temperaturbereich zwischen 298 K und 385 K beschreiben.[11]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−359,2 kJ·mol−1[12]
−312,6 kJ·mol−1[12]Standardentropie S0liquid
S0solid189,5 J·mol−1·K−1[13]
170,87 J·mol−1·K−1[8]als Flüssigkeit
als FeststoffVerbrennungsenthalpie ΔcH0liquid −2644,0 kJ·mol−1[14] Wärmekapazität cp 215,37 J·mol−1·K−1 (25 °C)[15]
2,91 J·g−1·K−1 (25 °C)[15]
113,63 J·mol−1·K−1 (25 °C)[16]
1,53 J·g−1·K−1 (25 °C)[16]als Flüssigkeit
als GasKritische Temperatur Tc 506,2 K[17] Kritischer Druck pc 39,7 bar[17] Schmelzenthalpie ΔfH 6,7 kJ·mol−1[18] beim Schmelzpunkt Verdampfungsenthalpie ΔVH0
ΔVH46,74 kJ·mol−1 [11]
39,07 kJ·mol−1 [11]
beim Normaldrucksiedepunkt
 Dampfdruckfunktion von tert.-Butanol
Dampfdruckfunktion von tert.-Butanol Temperaturabhängigkeit der Verdampfungsenthalpie von tert.-Butanol
Temperaturabhängigkeit der Verdampfungsenthalpie von tert.-Butanol
Sicherheitstechnische Kenngrößen
2-Methyl-2-propanol ist ein leicht entzündlicher Feststoff. Die Verbindung hat einen Flammpunkt von 11 °C, das heißt, es können sich bereits unterhalb des Schmelzpunktes über festem 2-Methyl-2-propanol entzündliche Dampf-Luft-Gemische bilden.[19] Der Explosionsbereich liegt zwischen 1,4 Vol.‑% (43 g/m3) als untere Explosionsgrenze (UEG) und 10,9 Vol.‑% (250 g/m3) als obere Explosionsgrenze (OEG).[2] In Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt sich ein unterer Explosionspunkt von 9 °C. Die Grenzspaltweite wurde mit 1,01 mm bestimmt.[2][19] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2][19] Die Zündtemperatur beträgt 470 °C.[19] Der Stoff fällt somit in die Temperaturklasse T1.
Chemische Eigenschaften
Wie alle aliphatischen Alkohole kann die Hydroxygruppe des 2-Methyl-2-propanols deprotoniert werden und man erhält das tert-Butylat-Anion. Ein bekanntes und in der organischen Synthesechemie oft verwendetes Salz ist das Kalium-tert-butanolat, das z. B. durch Reaktion von 2-Methyl-2-propanol mit elementarem Kalium zugänglich ist.
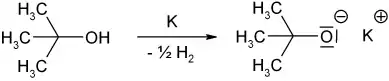
Dieses stark basische Salz findet als sterisch anspruchsvolle und daher nur schwach nukleophile Base Anwendung, zum Beispiel bei Deprotonierungen, bei denen die Base nicht nukleophil angreifen darf. Oft verwendet man dann auch 2-Methyl-2-propanol als Lösungsmittel.
Von starken Protonensäuren (Salzsäure, Schwefelsäure, Phosphorsäure etc.) wird 2-Methyl-2-propanol am Sauerstoffatom protoniert und unter Abspaltung von Wasser bildet sich das tert-Butyl-Kation, das durch den Hyperkonjugationseffekt der drei Methylgruppen stabilisiert ist. In Gegenwart von guten Nukleophilen verläuft die Reaktion im Sinne einer nukleophilen Substitution (SN1) weiter. Beispielsweise bildet sich das 2-Chlor-2-methylpropan (tert-Butylchlorid) sehr leicht aus 2-Methyl-2-propanol und konzentrierter Salzsäure. Sind keine geeigneten Nukleophile zugegen (z. B. bei Verwendung von Schwefelsäure oder Phosphorsäure), so verläuft die Reaktion im Sinne einer Eliminierung (E1) zu 2-Methylpropen (Isobuten). Dies ist die Umkehrung der Herstellung von 2-Methyl-2-propanol.
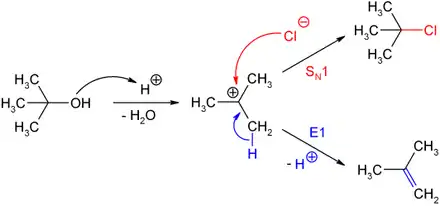
Verwendung
tert-Butanol wird als Treibstoffzusatz zur Verhinderung einer Vergaservereisung bzw. als Antiklopfmittel verwendet.[20] Weiterhin dient der Alkohol als Ausgangsstoff zur Synthese von tert-Butylestern und tert-Butylphenolen, die wiederum als Antioxidantien eingesetzt werden.[20] Man benutzt es außerdem als Lösungsmittel bei der kryoskopischen Molmassebestimmung[20] sowie bei der gaschromatographischen Bestimmung der Blutalkoholkonzentration (Headspace-GC) als internen Standard.[21] Weiterhin wird tert-Butanol als zusätzliches Vergällungsmittel für Trinkalkohol (Ethanol) verwendet.
In der Synthesechemie wird es u. a. auch zur Entsorgung von Resten der Alkalimetalle Kalium und Natrium eingesetzt, da es damit kontrollierbar zu tert-Butanolaten reagiert.
Sicherheitshinweise / Risikobewertung
2-Methyl-2-propanol kann beim Haut- und Augenkontakt reizend wirken. Beim Einatmen verursacht es weiterhin Husten, dadurch wird es auch vom Körper resorbiert. Bei Verschlucken kann es zu Übelkeit und Erbrechen kommen. Nach der Resorption können Benommenheit, Schwindel, Atemlähmung, Blutdruckabfall und Herz-Kreislaufstörungen auftreten. 2-Methyl-2-propanol ist schwach wassergefährdend (Wassergefährdungsklasse 1).
tert-Butanol wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von tert-Butanol waren die Besorgnisse bezüglich Verbraucherverwendung, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen. Die Neubewertung läuft seit 2013 und wird vom Vereinigten Königreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[22][23]
Einzelnachweise
- Eintrag zu T-BUTYL ALCOHOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu 2-Methyl-2-propanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu 2-methylpropan-2-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-65-0 bzw. Tert-Butanol), abgerufen am 2. November 2015.
- TERT-BUTANOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 26. Juli 2021.
- 2-METHYL-PROPAN-2-OL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 26. Juli 2021.
- Patent DE10330710A1: Verfahren zur Herstellung von tert.-Butanol. Veröffentlicht am 1. Juli 2004, Anmelder: Oxeno Olefinchemie GmbH, Erfinder: Andreas Beckmann, Wilfried Büschken, Silvia Santiago Fernandez, Alfred Kaizik, Franz Nierlich, Dieter Reusch, Bernhard Scholz.
- F. L. Oetting: The heat capacity and entropy of 2-methyl-2-propanol from 15 to 330 K. In: J. Phys. Chem. 67, 1963, S. 2757–2761, doi:10.1021/j100806a059.
- Y. Demirel: Estimation of the entropy of vaporization at the normal boiling point for azeotropic mixtures containing water, alcohol or acetic acid. In: Thermochim. Acta. 339, 1999, S. 79–85, doi:10.1016/S0040-6031(99)00211-7.
- I. Brown, W. Fock, F. Smith: The Thermodynamic Properties of Solutions of Normal and Branched Alcohols in Benzene and n-Hexane. In: J. Chem. Thermodyn. 1, 1969, S. 273–291, doi:10.1016/0021-9614(69)90047-0.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford, 1985, S. 300.
- K. B. Wiberg, S. Hao: Enthalpies of hydration of alkenes. 4. Formation of acyclic tert-alcohols. In: J. Org. Chem. 56, 1991, S. 5108–5110, doi:10.1021/jo00017a022.
- G. S. Parks, K. K. Kelley, H. M. Huffman: Thermal data on organic compounds. V. A revision of the entropies and free energies of nineteen organic compounds. In: J. Am. Chem. Soc. 51, 1929, S. 1969–1973, doi:10.1021/ja01382a003.
- H. A. Skinner, A. Snelson: The heats of combustion of the four isomeric butyl alcohols. In: Trans. Faraday Soc. 56, 1960, S. 1776–1783, doi:10.1039/TF9605601776.
- M. Caceres-Alonso, M. Costas, L. Andreoli-Ball, D. Patterson: Steric effects on the self-association of branched and cyclic alcohols in inert solvents. Apparent heat capacities of secondary and tertiary alcohols in hydrocarbons. In: Canadian Journal of Chemistry. 66 (4), 1988, S. 989–998, doi:10.1139/v88-165.
- Thermodynamics Research Center, Selected Values of Properties of Chemical Compounds., Thermodynamics Research Center, Texas A&M University, College Station, Texas, 1997.
- M. Gude, A. S. Teja: Vapor-Liquid Critical Properties of Elements and Compounds. 4. Aliphatic Alkanols. In: J. Chem. Eng. Data. 40, 1995, S. 1025–1036, doi:10.1021/je00021a001.
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1996, S. 1–525, doi:10.1063/1.555985.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Eintrag zu Butanole. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2018.
- Harald Schütz: Alkohol im Blut. Nachweis und Bestimmung, Umwandlung, Berechnung. Verlag Chemie, Weinheim 1983, ISBN 3-527-26094-3.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2-methylpropan-2-ol, abgerufen am 1. Mai 2020.

